從核苷修飾說起,帶你瞭解mRNA修飾的奧秘
Novoprotein 2023-10-25 19:06 發表於浙江
mRNA技術的應用領域非常廣泛,目前主要用於傳染性疾病疫苗、腫瘤免疫治療、蛋白質替代療法和基因編輯等方面,尤其在腫瘤免疫治療和傳染性疾病疫苗的應用上較為突出。公開數據顯示,全球有超過150個mRNA疫苗藥物項目正在推進,明確核准及進入臨床階段的也有近百個,其中約70%為感染性疫苗項目,約30%為腫瘤治療性疫苗項目。
諾貝爾生理學/醫學獎授予了美國科學家卡塔林·卡裡科和德魯·魏斯曼,以表彰他們「他們發現了核苷鹼基修飾,從而開發出有效的新冠肺炎mRNA疫苗」。本文總結了mRNA的其他更多重要修飾。
.png)
圖1. mRNA疫苗的作用機制(Wadhwa A et al. 2020)
體外合成mRNA的修飾
1. 5′端加帽
RNA聚合酶催化RNA的轉錄合成,此過程以DNA為範本;RNA聚合酶作用於DNA範本鏈的3'端,RNA鏈從5'端延伸至3'端。轉錄的同時,mRNA的5'端進行加帽反應,7-甲基鳥嘌呤透過5'-5'三磷酸鍵與mRNA的5'端連接。依甲基化修飾的程度不同分為3種帽結構:Cap0、Cap1和Cap2(圖3)。
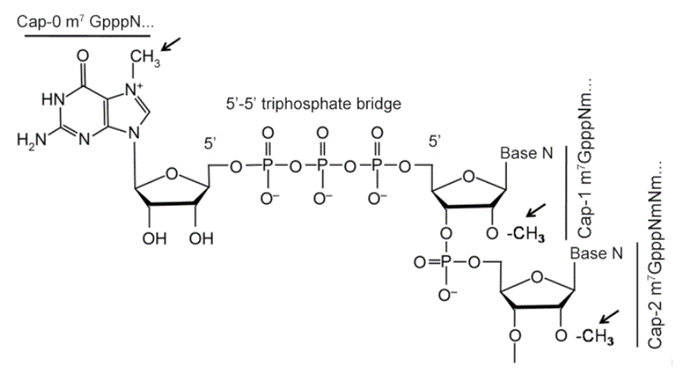
圖2. 5'端加帽mRNA的結構,cap0, cap1, cap2結構和5'ppp5'結構,對應的甲基化位置以箭頭指示(Chen Y et al . 2016)
體外合成的RNA需要透過一定的合成過程完成5'端帽結構的添加,以形成完整的mRNA結構。mRNA的完整性確保了蛋白質的準確翻譯,5'-Cap帽結構修飾可以保護mRNA免受5'-外切酶活性降解、有效促進翻譯的起始、降低免疫原性。常用的加帽製程有兩類,一類是在IVT結束後,透過牛痘病毒加帽酶和2'-O-甲基轉移酶的共同作用,完成Cap1的修飾;一類是在IVT過程中,透過在體系內引入帽類似物,完成帽結構的修飾。兩種方式在工藝、結果以及智慧財產權壁壘等方面各不相同。
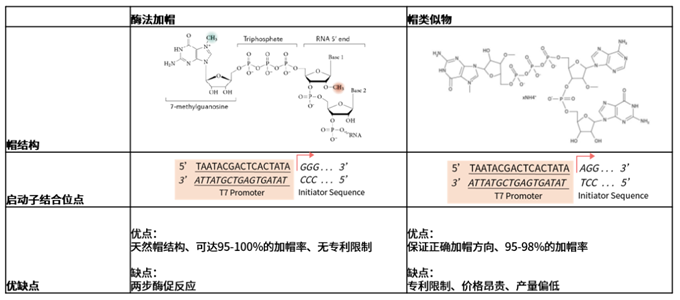
圖3. 酵素法加帽與共轉錄加帽的比較,圖片引用於Novoprotein Scientific Inc.
酵素法加帽過程:在RNA三磷酸酶作用下,mRNA 5'端γ-磷酸基團被移除,生成5'-二磷酸RNA;在鳥苷酸轉移酶(guanylyl-transferase)作用下,GTP中的GMP基團與5'-二磷酸RNA連接;在鳥嘌呤N-7甲基轉移酶(guanine-N(7)-methyltransferase)作用下,鳥嘌呤的N7位發生甲基化(甲基供體為S-腺苷甲硫胺酸[SAM]),形成帽結構Cap0(m7GpppNpNp)。而後在2'-O核糖甲基轉移酶(2' -O Ribose methyltransferase)作用下,mRNA第一個核苷酸的2'-O位發生甲基化,形成帽結構Cap1(m7Gpppm2'NpNp); mRNA第一個和第二個核苷酸的2'-O位均發生甲基化,形成帽結構Cap2(m7Gpppm2'Npm2'Np)(圖5)。
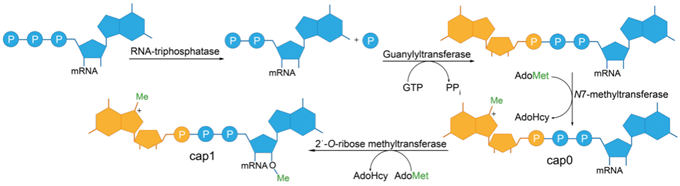
圖4. 真核生物mRNA中酵素5 '端帽形成的示意圖(Muttach F et al . 2017 )
Novoprotein提供mRNA加帽過程中所需的2種加帽酶:牛痘病毒加帽酶(目錄編號:GMP-M062、M062)和mRNA Cap2'-O-甲基轉移酶(目錄編號:GMP- M072、M072)及完整試劑盒(目錄編號:M082)。
2. 3′-端加尾
體外合成mRNA的加尾方式主要有兩種:(A)以Poly(A) Polymerase酶促方式加尾;(B)在範本上引入編碼PolyA的序列(圖6)。PolyA尾與透過核膜有關,也可防止核酸外切酶降解。這種多聚腺苷酸尾巴很重要,它的長度決定了mRNA在細胞中的存在時間,以及細胞利用mRNA表達蛋白的頻率。這種多聚腺苷酸尾巴也是mRNA從細胞核遷移出去所必需的。早期基於實驗證據的假說認為,Poly(A)尾與胞漿中的多聚腺苷結合蛋白(PABPC)促進翻譯並阻止mRNA降解(decay),但具體機制並不清楚。最近對Poly(A)尾的作用認識更為豐富:Poly(A)結合蛋白可以促進Poly(A)的去除(即脫腺苷化,deadenylation),而當mRNA穩定且高頻翻譯時,Poly( A)在穩態下的長度遠低於預期。此外,翻譯延伸的速率會影響脫腺苷化。因此,Poly(A)尾、PABPC、翻譯過程和mRNA降解間的相互作用在基因調控中扮演重要角色。
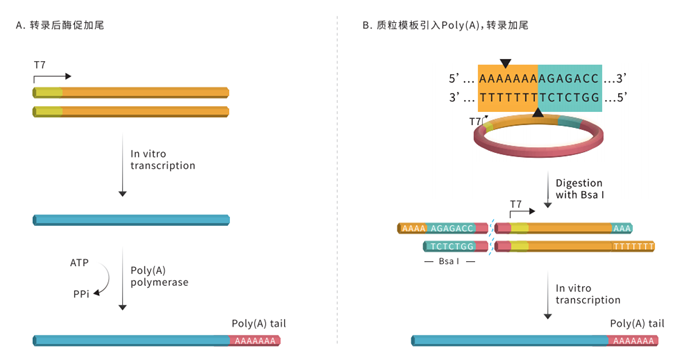
圖5. 2種加尾法:(A)轉錄後酵素加尾;(B)用Bsal 將範本線性化後進行轉錄
Novoprotein提供mRNA加尾過程種所需的加尾酶 E. coli Poly(A) Polymerase(目錄編號:GMP-M012、M012)。
3. 化學修飾
mRNA中還存在很多化學修飾,有堿基的修飾,也有核糖的修飾。這些修飾可以參與mRNA的剪接、核輸出、轉錄本穩定性和翻譯起始等事件,進而調控多種生理及病理過程。迄今為止共鑒定出超過170種RNA化學修飾,mRNA中常見的修飾包括N6-甲基腺苷(N6-Methyl-Adenosine,m6A),5-甲基胞嘧啶(5-methylcytosine,m5C),N1-甲基腺苷(N1-methyladenosine ,m1A),N7-甲基鳥苷(N7-methylguanosine ,m7G),N4-乙醯胞嘧啶(N4-acetylcytosine,ac4C),假尿苷(Ψ),肌苷(I)和核糖甲基化(2'-O-Me),5-甲氧基-尿苷(5-Methoxy-Uridine,5moU)等。其中m6A最為普遍,研究也較多(圖7)。
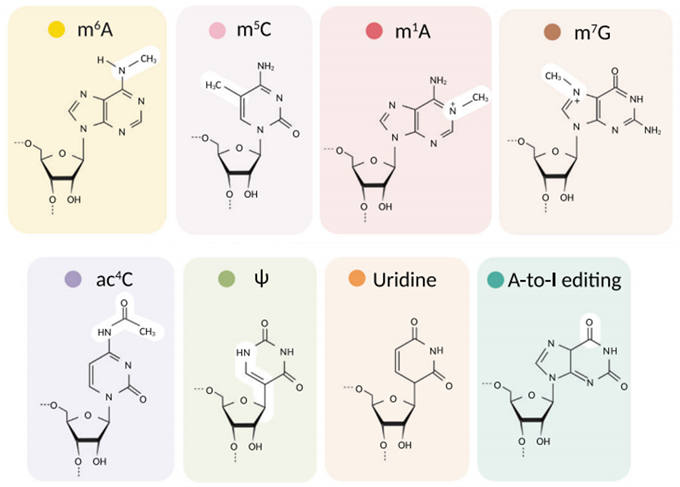
圖6. 真核生物mRNA的化學修飾成分(Cui L et al. 2022)
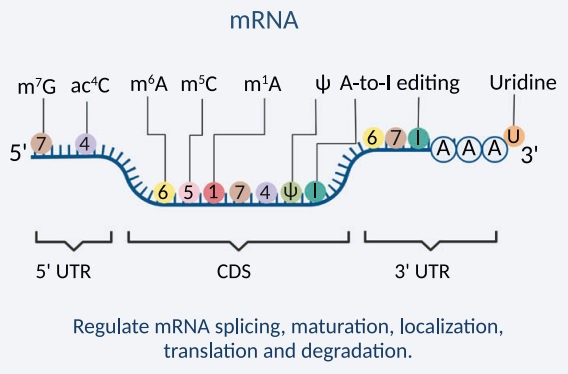
圖7. 化學修飾在mRNA中的位置(Cui L et al. 2022)
採用修飾核苷酸合成的mRNA可以通過體外轉錄技術經濟高效地大規模生產,並且可以在細胞質中快速暫態表達,而不會有整合到基因組中的風險。然而,未修飾的合成mRNA不穩定並刺激細胞先天免疫的啟動。由於環境RNA酶的高活性,未修飾的合成mRNA在很大程度上存在降解問題。進入細胞後,未修飾的RNA分子會被多種信號受體識別,例如內體Toll樣受體、細胞質蛋白激酶R、2′-5′-寡腺苷酸合成酶(OAS)、視黃酸誘導基因I(RIG-I)或黑色素瘤分化相關基因5(MDA5),並誘導I型干擾素、白細胞介素-6和其他促炎細胞因數的產生,從而刺激細胞先天免疫的啟動。
修飾核苷酸主要是通過阻礙信號受體識別mRNA,避免下游信號通路的啟動從而逃避先天免疫反應。Ψ通過阻礙TLR7/8、PKR、OAS和RIG-I介導的信號通路的刺激來降低細胞內先天免疫原性。值得強調的是,這些細胞受體不僅能感知某些修飾的存在與否,還能感知RNA鏈特徵(單鏈或雙鏈RNA)以及堿基修飾的位置和組合。m5C通過阻止TLR7/8,PKR和RIG-1介導的信號通路的的刺激來降低細胞內先天免疫原性,並穩定mRNA,從而延長半衰期。m6A修飾可降低TLR3/7/8、PKR、MDA5、OAS和RIG-I與mRNA的結合,從而逃避先天免疫。
Novoprotein mRNA技術-原料/服務一站式解決方案提供包括T7 High Yield RNA Transcription kit (E131) 在內的RNA體外轉錄所需的多種原料酶和相關輔助試劑,可以滿足廣大研究者多方面的生產和實驗需求。
相關產品
| 目錄號 | 產品名稱 |
| E131 |
T7 High Yield RNA Transcription kit
|
| E137 |
T7 High Yield RNA Transcription Kit (N1-Me-Pseudo UTP)
|
| E139 |
T7 High Yield RNA Transcription Kit with CAP1 GAG (3´OMe)
|
| E141 |
T7 High Yield RNA Transcription Kit with CAP1 GAG
|
| M062 |
Vaccinia Capping Enzyme
|
| M072 |
mRNA Cap 2´-O-Methyltransferase
|
| M082 | Cap 1 Capping System |
| M012 | E. coli Poly(A) Polymerase |
| E127 | DNase I |
| GMP-S023A | ATP, GMP Grade |
| GMP-S026A | UTP, GMP Grade |
| GMP-S025A | CTP, GMP Grade |
| GMP-S024A | GTP, GMP Grade |
| GMP-S042 | N1-Me-Pseudo UTP, GMP Grade |
| GMP-S048 | Pseudo UTP, GMP Grade |
| MR008 | eGFP mRNA |
| MR010 | eGFP mRNA(N1-Me-Pseudo UTP) |
| MR009 | Luciferase mRNA |
| MR011 | Firefly Luciferase mRNA (N1-Me-Pseudo UTP) |
| MR016 | hEPO mRNA (N1-Me-Pseudo UTP) |
| MR015 | OVA mRNA (N1-Me-Pseudo UTP) |
| MR105 | mCherry mRNA(N1-Me-Pseudo UTP) |
| MR201 | eGFP circRNA |
| MR202 | Luciferase circRNA |
| MR019 | Cas9 mRNA (N1-Me-Pseudo UTP) |
| MR107 | Cas9 mRNA |
參考文獻
1. Wadhwa A, Aljabbari A, Lokras A, Foged C, Thakur A. (2020) Opportunities and Challenges in the Delivery of mRNA-based Vaccines. Pharmaceutics. Jan 28;12(2):102.
2. Chen Y, Guo D. (2016) Molecular mechanisms of coronavirus RNA capping and methylation. Virol Sin. Feb;31(1):3-11.
3. Muttach F, Muthmann N, Rentmeister A. (2017) Synthetic mRNA capping. Beilstein J Org Chem. Dec 20;13:2819-2832.
4. Cui L, Ma R, Cai J, Guo C, Chen Z, Yao L, Wang Y, Fan R, Wang X, Shi Y. (2022) RNA modifications: importance in immune cell biology and related diseases. Signal Transduct Target Ther . Sep 22;7(1):334.
