千億市場,GLP-1R/GCGR/GIPR/FGF21降糖減重明星靶點強勢入局
Novoprotein 2023-11-02 15:14 發表於浙江
糖尿病被認為是成長最快的全球健康問題,根據國際糖尿病聯盟估計,到2045年,全球糖尿病人口將達到7.83億。在糖尿病病例中第2型糖尿病(T2DM)佔90%以上。
胰臟β細胞功能障礙導致的胰島素缺乏是T2DM的主要特徵,然而,大多數藥物並非針對β細胞,且對糖尿病的進展療效不佳。腸促胰島素(GLP-1/GIP)可以刺激胰島素分泌,啟發了新的T2DM治療方法。健康狀態下GLP-1和GIP都能促進胰島素分泌,但單獨使用GIP的治療潛力有爭議。相較之下,GLP-1受體(GLP1R)被認為是T2DM治療中最重要的潛在藥物標靶之一,與胰島素和磺醯脲類藥物相比,GLP1R可降低低血糖風險[1 ]。除了GLP1R標靶之外,研究者也發現GIPR、GCGR以及FGF19/21在降血糖減重治療中也扮演重要角色。
Novoprotein提供GLP1R / GIPR / GCGR / FGF-21等多種降血糖減重熱門標靶,適用於機制研究和標靶藥物開發。
GLP1R簡介
G蛋白偶聯受體(GPCRs)廣泛分佈於多種組織中,在多種生理活動中發揮關鍵作用。作為最大的受體家族,GPCRs是廣泛適應症的重要藥物標靶。GPCRs共用一個保守的七跨膜螺旋束,有三個細胞外環(ECLs)和三個細胞內環(ICLs)。ECLs形成與正構配體相互作用的細胞外表面,而ICLs在很大程度上決定下游受體訊號傳導[1]。
GLP-1作為GLP1R的內源性激動劑,具有厭氧、促胰島素和減肥作用,是一種很有前景的天然降血糖產品。然而,在體內,二肽基肽酶4 (DPP-4)在其N端分泌第二氨基酸(丙氨酸)後可立即將GLP-1切割,這將導致GLP-1立即降解,在人體內循環時間短。儘管GLP-1具有許多潛在的優勢,但其循環時間約為2分鐘,頻繁給藥與患者的依從性不相容,從而降低了藥物的有效性,限制了其在治療中的應用。延長循環時間的DPP-4抑制劑和GLP-1類似物已應用於腸促胰島素治療並取得良好效果。然而,GLP1R激動劑由於具有更好的體重控制和心血管預後效果備受青睞[1] 。
為了闡明GLP1R訊號傳導的機制,研究人員多年來一直在進行GLP1R的功能研究。GLP1R下游訊號路徑網路可透過與胞內換能器偶聯而活化。不同的蛋白質結合形式將導致複雜的下游途徑。目前認為GLP1R主要透過Gαs/cAMP路徑發出訊號;然而,有證據顯示GLP1R與Gαq和其他G蛋白偶聯。活化後,GLP1R在C端發生磷酸化,進一步募集β-arrestin,導致受體內化和脫敏。Gαs/cAMP途徑直接導致葡萄糖誘導的胰島素顆粒分泌。在被GLP-1等完全激動劑活化後,GLP1R與Gαs偶聯,活化腺苷酸環化酶(AC),造成cAMP的累積。隨著cAMP水準的升高,蛋白激酶A (PKA)和由cAMP-2(Epac-2)直接活化的交換蛋白也被活化。PKA和Epac-2觸發KATP和KV通道的關閉,從而使細胞膜去極化,打開電壓依賴性鈣通道(VDCC),並引起Ca2+內流。除了cAMP的經典功能外,cAMP/CREB路徑還能誘導胰島素受體底物2 (insulin receptor substrate 2, IRS2)的表達,促進β-細胞存活,證明GLP-1類似物對β-細胞的保護作用[1] 。
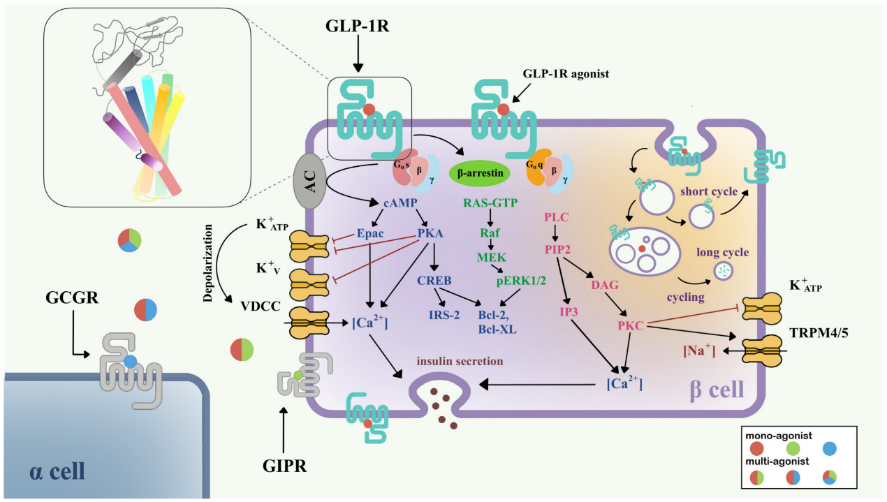
圖1. GLP1R在胰島β細胞中的訊息傳遞路徑[1]
胰高血糖素樣勝肽-1受體(GLP1R)是第2型糖尿病(T2DM)的關鍵治療標靶。許多針對GLP1R的藥物已經進入臨床治療。然而,對副作用小、療效高的新型功能分子的需求仍然很大。
GIPR簡介
GIPR(Gastric inhibitory polypeptide receptor,胃抑制勝肽受體)是GIP的受體,是具有7個跨膜域的G蛋白偶聯受體。GIP透過與GIPR的作用,來調節身體的能量代謝,特別是腸促胰素效應。研究顯示GIPR在調控胰島素分泌、血糖和脂代謝方面扮演著重要的角色,對維持正常的代謝狀態至關重要。
目前GLP-1受體激動劑(GLP1RA)類藥物目前已被確定為不僅治療T2D而且治療肥胖的藥理學療法,並且可能對患有心腎功能障礙的T2D患者有進一步的益處。然而,儘管GLP-1療法具有令人信服的特性,許多患者仍然沒有達到他們的血糖和體重下降目標。肥胖和T2D的結合,推動了對能夠補充和增強GLP1R激動作用的藥物的需求。預計下一代T2D藥物將被設計為透過單分子藥物的新型製藥工程來參與互補機制。其中一個策略是集中在產生單肽激動劑,以利用GLP1R活性,同時也靶向葡萄糖依賴性胰島素性多肽受體(GIPR)。這種新方法的目的是進一步增加代謝益處,同時盡量減少不良事件。重要的是,這種方法已經增強了T2DM患者的血糖控制和前所未有的體重減輕,突顯了GIPR訊號軸作為一個有希望和有效的共同標靶。因此,雙重激動劑激發了人們對瞭解GIPR參與如何有助於增強代謝控制的新興趣,特別關注對減肥的明顯有益影響[2] 。
Lu等人的研究表明,用雙特異性分子對抗/活化GIPR/GLP1R路徑可以降低肥胖小鼠和猴子的體重和代謝參數。機制研究表明,這些分子同時與GIPR和GLP1R結合並觸發受體內化,在表達這兩種受體的細胞中放大cAMP訊號[3] 。
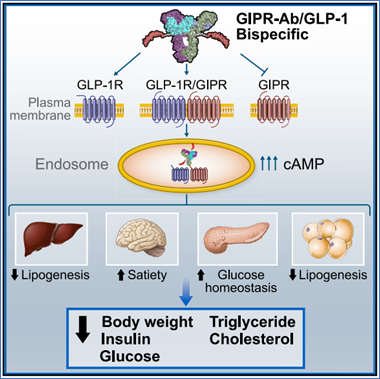
圖2. 雙特異性分子對抗/活化GIPR/GLP1R路徑[3]
GCGR簡介
胰高血糖素是一種線性肽,含有29個氨基酸。它由胰島細胞分泌,主要作用於肝細胞。GCGR是一種主要存在於胰島β細胞和肝細胞中的G蛋白偶聯受體(GPCR)。啟動GCGR和GLP1R促進胰島β細胞胰島素分泌。胰高血糖素與β細胞上的GCGR和GLP1R結合,啟動的受體與G蛋白Gαs結合。這導致腺苷酸環化酶啟動和cAMP形成。葡萄糖與GLUT2結合,增加ATP水準和細胞內鈣濃度,增強胰島素胞外分泌。細胞內cAMP水準的增加啟動PKA,這也促進胰島素胞外分泌[4]。
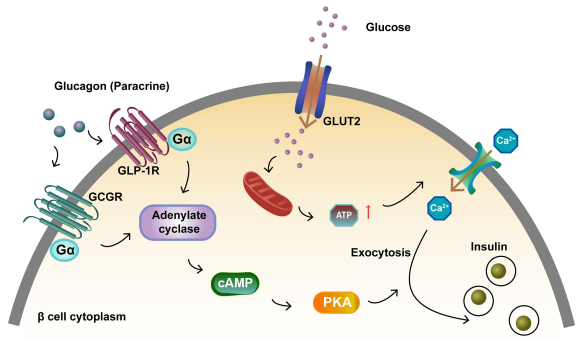
圖3. 啟動GCGR和GLP1R促進胰島β細胞胰島素分泌[4]
目前GCGR拮抗劑已被提議作為治療T1D或T2D的藥理學方法,包括使用小分子拮抗劑、針對GCGR的單克隆抗體(mAb)和降低受體表達的反義寡核苷酸。相關臨床試驗表明,它們可以通過抑制胰高血糖素的作用來降低血糖水準。REMD 477是抗GCGR的完全競爭性單抗。單劑量REMD-477可顯著降低T1D患者的胰島素需求,改善患者的血糖控制,無嚴重不良反應。另一種GCGR單克隆抗體REGN1193具有良好的安全性和耐受性,但也觀察到轉氨酶短暫升高。綜上所述,GCGR單克隆抗體有望改善血糖控制,具有很大的研究前景[4]。
FGF-19/21簡介
2005年,Kharitonenkov等人在一項基於細胞的高通量篩選研究中首次發現FGF21的代謝活性具有降低血糖的積極作用,因為它能夠誘導脂肪細胞攝取葡萄糖[5]。雖然肝臟是迴圈FGF21的主要來源,但FGF21的表達也可在其他幾個代謝器官中檢測到,包括脂肪組織、胰島和骨骼肌[6-7]。2018年,上海交通大學附屬第六人民醫院內分泌代謝科賈偉平教授課題組在《自然》子刊《自然通訊》上發表題為“Fibroblast growth factor 21 increases insulinsensitivity through specific expansion of subcutaneous fat”的研究成果。該研究發現,在能量攝入過剩時,肝臟分泌的激素樣因數成纖維細胞生長因數21(FGF21)能通過促進皮下脂肪的增生和調控其功能,從而維持胰島素敏感性和糖代謝穩態[8]。
成纖維細胞生長因數(FGF)家族蛋白在細胞增殖、分化、發育和代謝等方面發揮著多種作用。其中,兩個經典成員(FGF1和FGF4)和兩個內分泌成員(FGF19和FGF21)是全身能量穩態、糖/脂代謝和胰島素敏感性的重要調節因數。臨床前研究一致證明了這些FGFs在治療肥胖、糖尿病、血脂異常和非酒精性脂肪性肝炎(NASH)方面的治療益處。一些基因工程的FGF19和FGF21類似物具有改善的藥效學和藥代動力學特性,並已開發並進入臨床試驗的各個階段[9]。
目前抗體藥物開發進展狀況
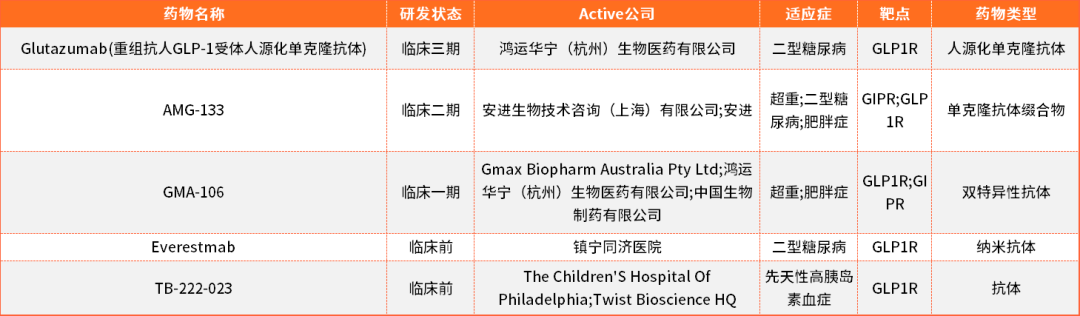
降糖減重藥物主要還是基於GLP1R靶點進行研究的,目前全球已經有多款上市的化藥和重組多肽類藥物,單抗和雙抗等藥物研發處於臨床或者臨床前階段,暫未有上市藥物。
表1.目前部分抗體藥物開發進展情況表(來源於藥渡資料庫)
部分產品資料展示:
.png)
Loaded Anti-Human GIPR Antibody(L7H6) on Pro-A Biosensor, can bind Recombinant Human GIPR N-ECD (C-6His) (Cat#C28P) with an affinity constant of 0.532 nM as determined in BLI assay.
%20(Bio-tag).png)
Loaded Anti-Human GIPR Antibody(L7H6) (Bio-tag) on SA Biosensor, can bind Recombinant Human GIPR N-ECD (C-Fc) (Cat#C28R) with an affinity constant of 1.12 nM as determined in BLI assay.
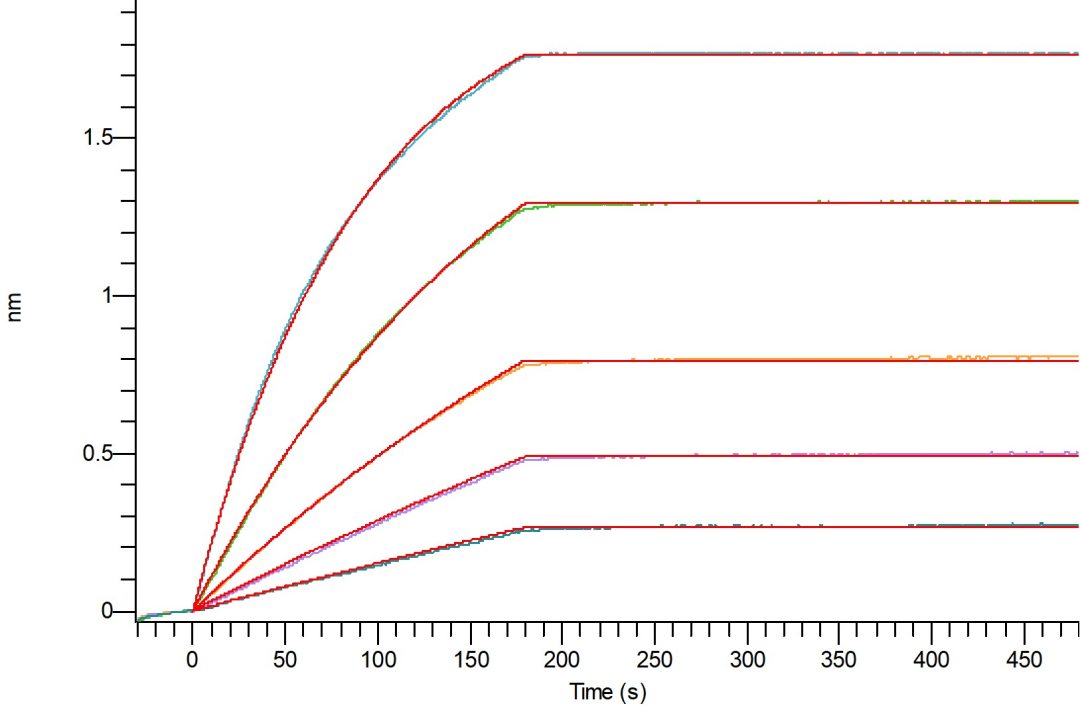
Loaded Biotinylated Human GIPR(C-6His-Avi) on HIS1K Biosensor, can bind Anti-Human GIPR Antibody(Human IgG1) with an affinity constant of 2.05 pM as determined in BLI assay.
(Cat%23C29K).png)
Loaded Recombinant Human GCGR N-ECD (C-6His)(Cat#C29K) on HIS1K Biosensor, can bind Anti-Human GCGR Antibody with an affinity constant of22.0 pM as determined in BLI assay.
| Cat. No. | Product Name |
| CU74 | Recombinant Human GLP1R(Arg24-Tyr145)(C-Fc) |
| C29P | Recombinant Human GLP1R N-ECD (C-6His) |
| C29R | Recombinant Human GLP1R N-ECD (C-Fc) |
| C29S | Recombinant Cynomolgus GLP1R N-ECD (C-6His) |
| C28P | Recombinant Human GIPR N-ECD (C-6His) |
| C28R | Recombinant Human GIPR N-ECD (C-Fc) |
| CY126 | Biotinylated Human GIPR N-ECD (C-6His-Avi) |
| C29F | Recombinant Mouse GIPR N-ECD (C-Fc) |
| C29G | Recombinant Mouse GIPR N-ECD (C-Fc) |
| C29H | Recombinant Cynomolgus GIPR N-ECD (C-Fc) |
| C29K | Recombinant Human GCGR N-ECD (C-6His) |
| C29M | Recombinant Human GCGR N-ECD (C-Fc) |
| CG74 | Recombinant Human FGF-19 (N-6His) |
| C223 | Recombinant Human FGF-21 (N-6His) |
| NC119 | Recombinant Human FGF-21 (N-6His) |
| C04D | Recombinant Mouse FGF-21 (C-6His) |
| CS24 | Recombinant Cynomolgus FGF-21 (C-6His) |
參考文獻
[1] Wan W, Qin Q, Xie L, Zhang H, Wu F, Stevens RC, Liu Y. GLP-1R Signaling and Functional Molecules in Incretin Therapy. Molecules. 2023 Jan 11;28(2):751.
[2] Samms, Ricardo J et al. “GIPR Function in the Central Nervous System: Implications and Novel Perspectives for GIP-Based Therapies in Treating Metabolic Disorders.” Diabetes vol. 70,9 (2021): 1938-1944.
[3] Lu, Shu-Chen et al. “GIPR antagonist antibodies conjugated to GLP-1 peptide are bispecific molecules that decrease weight in obese mice and monkeys.” Cell reports. Medicine vol. 2,5 100263. 33.
[4] Jia Y, Liu Y, Feng L, Sun S, Sun G. Role of Glucagon and Its Receptor in the Pathogenesis of Diabetes. Front Endocrinol (Lausanne). 2022 Jun 16;13:928016.
[5] Kharitonenkov A, Shiyanova TL, Koester A, Ford AM, Micanovic R, Galbreath EJ, Sandusky GE, Hammond LJ, Moyers JS, Owens RA, Gromada J, Brozinick JT, Hawkins ED, Wroblewski VJ, Li DS, Mehrbod Fod , Jaskunas SR, Shanafelt AB. FGF-21 as a novel metabolic regulator. J Clin Invest. 2005 Jun;115(6):1627-35.
[6] Geng L, Lam KSL, Xu A. The therapeutic potential of FGF21 in metabolic diseases: from bench to clinic. Nat Rev Endocrinol. 2020 Nov;16(11):654-667.
[7] Wente W, Efanov AM, Brenner M, Kharitonenkov A, Köster A, Sandusky GE, Sewing S, Treinies I, Zitzer H, Gromada J. Fibroblast growth factor-21 improves pancreatic beta-cell function and survivalby activation signal-regulated kinase 1/2 and Akt signaling pathways. Diabetes. 2006 Sep;55(9):2470-8.
[8] Li, Huating , et al. "Fibroblast growth factor 21 increases insulin sensitivity through specific expansion of subcutaneous fat." Nature Communications 9.1(2018):272.
[9] Jin L, Yang R, Geng L, Xu A. Fibroblast Growth Factor-Based Pharmacotherapies for the Treatment of Obesity-Related Metabolic Complications. Annu Rev Pharmacol Toxicol. 2023 Jan 20;63:359-382.
