近岸類器官課堂-如此「腎臟」好
Novoprotein2023-03-14 18:48 發表於浙江
哺乳動物的腎臟包含數千個腎單位,互相連接成為高度分枝化的集氣管(collecting duct, CD)系統。腎臟主要由兩個胚胎細胞群的相互作用形成:上皮性輸尿管芽(Ureteric bud,UB)和周圍的後腎間質(Metanephric mesenchyme, MM),其中MM包含腎單位前體細胞(Nephron progenitors, NPs )和基質前驅細胞(Stromal progenitors, SPs)【1】。在MM細胞的誘導下,UB逐漸發育並形成分枝。MM細胞聚集在UB的分枝尖端,形成帽狀間質,促進帽狀間質中的腎祖細胞增殖分化,形成聚集(Pre-tubular aggregate,PA)。隨後,PA和UB分別進行間質-上皮細胞轉化(Mesenchymal-epithelial transition, MET)和小管生成,進而形成腎單位【2】。目前廣泛用於腎臟研究的人類腎臟細胞系忽略了細胞外微環境,與在體的器官類型和整體特性仍有較大差異,不能充分體現腎臟的作用及其特點,而三維培養的腎類器官模型為腎臟的研究提供了新途徑。人源多能幹細胞衍生的腎臟類器官是一種由幹細胞分化而來,具有一定腎臟功能的組織結構。可以模擬腎臟發育和疾病發生,用於腎臟疾病的細胞修復治療、篩選改善腎功能藥物等情境。
本篇文章基於Cell Stem Cell 【3-4】和Nature Biotechnology 【5】發表的三篇文章,整理
了人類誘導多能幹細胞(hiPSCs)來源的腎類器官培養方案。此培養過程遵循發育原理,由多能幹細胞誘導得到UBs及NPs細胞。配合SPs細胞,有望實現體外培養具有腎臟高階結構的人類腎臟類器官。因為缺乏誘導SPs形成的方法,也無法獲得人類胚胎腎組織中的SPs,目前這個方案只在小鼠ESCs驗證過有效性和可行性。
.png)
圖1. 具有腎臟高階結構的腎臟類器官培養方案示意圖【3】
細胞來源
hiPSC
培養試劑配方
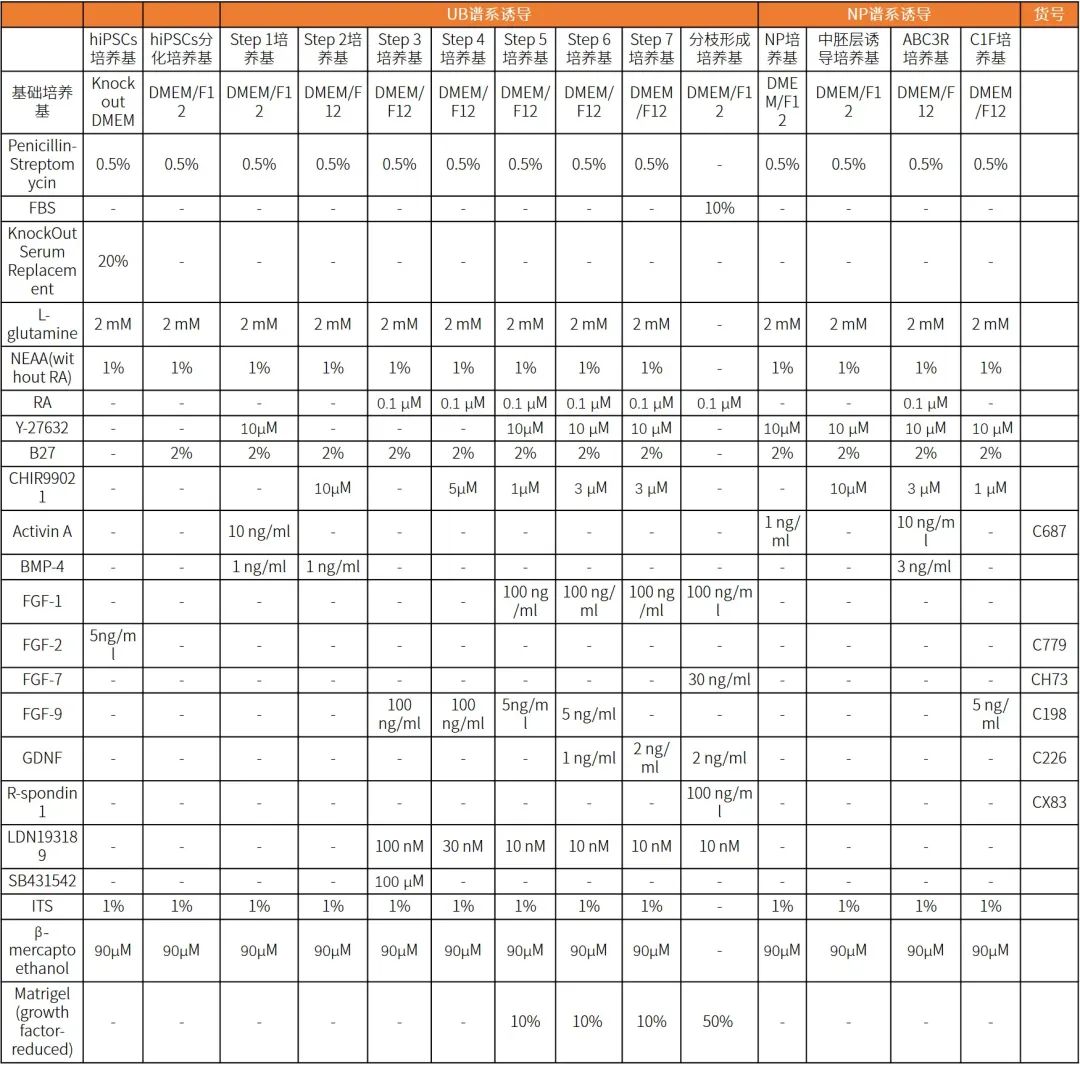
圖2 第7.5天的心臟類器官冷凍切片,顯示了腔體和CM特異性標記物TNNT2的表達[2]
一、hiPSCs培養
1. 將hiPSCs接種在用絲裂黴素C處理過的小鼠胚胎成纖維細胞(MEFs)上。
2. 加入1mg/ml膠原蛋白酶IV,將iPSCs克隆團從MEFs中分離出來。
3. 接著將分離出的iPSCs克隆團收集到錐形管中,靜置10min使iPSCs克隆團沉澱,棄掉上清液中的MEFs。
4. 沉澱的iPSCs克隆團用Accutase分離。
二、輸尿管芽(Ureteric bud, UB)譜系誘導
擬胚體(Embryoid bodies , EB)分化
5. 將分離的iPSCs轉移至V型底低吸附的96孔板中,加入iPSCs分化培養基培養。當細胞/克隆團數達到10,000個時,以Step1培養基換液,細胞將重新聚合成EB。
6. 培養24h後,將EB轉移到U型底低吸附的96孔板中,加入Step2培養基,培養36h。
7. 將細胞以Step3培養基換液,培養48h。
8. 將細胞以Step4培養基換液,培養42h。
中腎管(Wolffian duct, WD)前驅細胞成熟
9. 將上清吸出,加入0.25%胰酶/EDTA至沒過細胞,37℃消化6min解離細胞球。
10. 血清封閉後,加入含有CXCR4/KIT抗體的稀釋液(含1×HBSS, 1% BSA和0.035% NaHCO 3),進行流式分選細胞。
11. 分選出的陽性細胞(約5,000個)種在V型底低吸附的96孔板中,210 × g離心4 min。
12. 將細胞以Step5培養基換液,培養54h。
13. 將細胞轉移至含有Step6的培養孔中,培養48h。
14. 將細胞轉移至含有Step7的培養孔中,培養72h,形成UB球體。
誘導輸尿管芽(Ureteric bud, UB)分枝形成
15. 將UB球體轉移至24孔Transwell中,加入150μl分枝形成培養基。下層培養基為無Matrigel的分枝形成培養基。
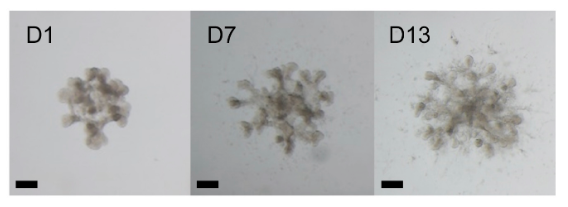
圖2. 光鏡下UB分枝形態,比例尺, 200 μm 【3】
三、腎單位前驅細胞(Nephron progenitors, NP)譜系誘導
5-2) . 將步驟4中的iPSCs轉移至V型底低吸附的96孔板中,當細胞/克隆團達到10,000個時,用NP培養基換液,細胞將重新聚合成EB。
6-2) . 培養24h後,將EB轉移到U型底低吸附的96孔板中,加入中胚層誘導培養基,每隔一天進行半換液,培養6天。
7-2). 將細胞以ABC3R培養基換液,培養48h。
8-2). 將細胞以C1F培養基換液,形成NP。
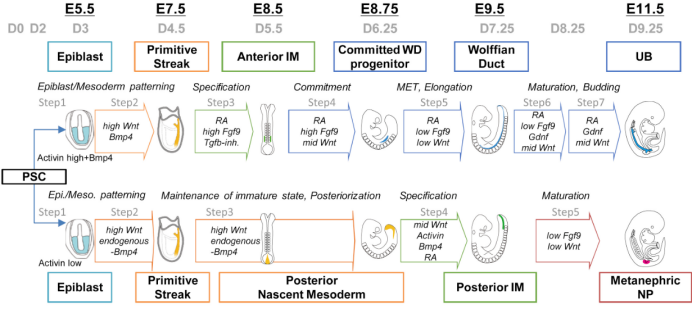
圖3. UB和NP的系譜分化模型【3】
用於再生醫學腎臟類器官
慢性腎病(Chronic kidney disease, CKD)目前影響全球11-13%的人口,其盛行率正在增加。老年人慢性腎病的高盛行率是年齡和心血管危險因子共同作用的結果,而青少年最常見的原因是小兒腫瘤(例如腎母細胞瘤)和先天性腎臟和泌尿道異常(CAKUT)。目前全世界有200萬人依賴透析,沒有腎臟移植的選擇。鑑於透析的高死亡率和社會經濟負擔,迫切需要替代的治療方法。再生醫學領域旨在以源自人類多能幹細胞(hPSC)的腎臟類器官的形式進行疾病治療,從健康供體或腎病患者產生的hPSCs還可以解決免疫相容性和患者特異性的問題。基於此,目前已有多項研究建構了不同成熟度的腎臟類器官(如圖4),距離腎臟類器官的臨床應用已經越來越近了。
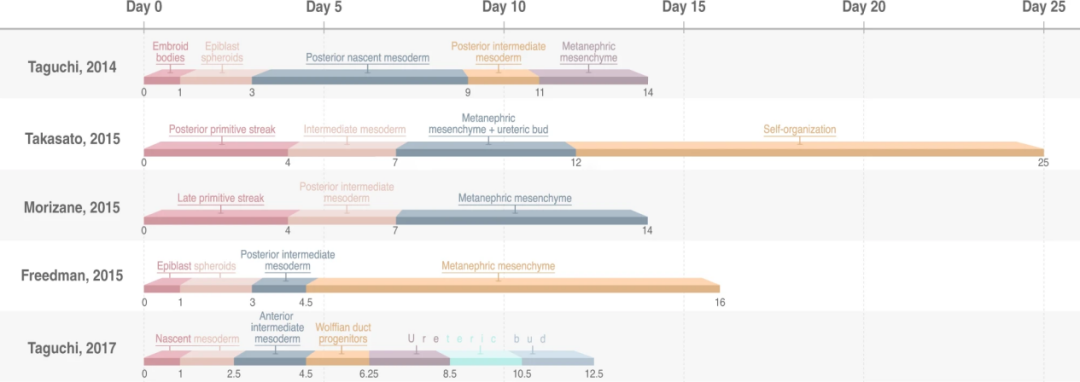
圖4. hPSC來源腎臟類器官的多種培養方案【6】
Novoprotein自主研發生產並經過類器官培養驗證的低內毒素Wnt3a、R-Spondin 1、Noggin、 FGF-10、FGFb和Shh等細胞因子,內毒素低至<10EU/mg,具有高活性、高純度、高批間一致性,為類器官培養設計,已獲得市場認可,讓您研究放心!
| 目錄號 | 產品名稱 |
| C076 | Human/Mouse/Rat BDNF |
| C012 | Human/Mouse/Rat BMP-2 |
| C688 | Human DKK1 (N-8His) |
| C029 | Human EGF |
| CH28 | Mouse EGF (C-6His) |
| CR08 | Human FGF-4 |
| CR66 | Mouse FGF-4 |
| CR11 | Human FGF-10 |
| CG74 | Human FGF-19 |
| CJ72 | Human HGF (C-6His) |
| CC13 | Mouse HGF (C-6His) |
| CH50 | Recombinant Human IL-22 |
| C047 | Recombinant Mouse IL-22 |
| C017 | Human LIF |
| C690 | Mouse LIF |
| CB89 | Human Noggin |
| C028 | Mouse Noggin(C-6His) |
| C753 | Human NRG1-beta 1 |
| C079 | Human NT-3 |
| C099 | Human OSM (N-6His) |
| C736 | Human Prolactin/PRL |
| C18C | Human R-spondin 3 (C-6His) |
| C100 | Human Shh |
| C089 | Human Shh (C24II) |
| CH69 | Mouse Shh |
| CH66 | Mouse Shh(C25II) |
| CA59 | Human TGF-beta 1 |
| C083 | Human VEGF165 |
| CX73 | Mouse VEGF164 |
| CJ96 | Rat VEGF164 |
| C22R | Human Wnt3a V3 |
參考文獻
【1】Zeng Z, Huang B, Parvez RK, et al. Generation of patterned kidney organoids that recapitulate the adult kidney collecting duct system from expandable ureteric bud progenitors[J]. Nature Communications , 2021, 12641 .
【2】Nishita M, Qiao S, Miyamoto M, et al. Role of Wnt5a-Ror2 signaling in morphogenesis of the metanephric mesenchyme during ureteric budding[J]. Molecular and cellular biology , 2014, 34(16): 301669 .
【3】Taguchi A, Nishinakamura R. Higher-order kidney organogenesis from pluripotent stem cells[J]. Cell stem cell , 2017, 21(6): 730-746. e6.
【4】Taguchi A, Kaku Y, Ohmori T, et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells[J]. Cell stem cell , 2014, pluripotent stem cells[J]. Cell stem cell , 2014, 143 ( -67.
【5】Oldershaw RA, Baxter MA, Lowe ET, et al. Directed differentiation of human embryonic stem cells toward chondrocytes[J]. Nature biotechnology , 2010, 28(11): 1187-1biotechnology , 2010, 28(11): 1187-1194.
【6】Geuens T, van Blitterswijk CA, LaPointe VL S. Overcoming kidney organoid challenges for regenerative medicine[J]. NPJ Regenerative medicine , 2020, 5(1): 8.
