類器官「兵團」助陣新冠抗疫戰
Novoprotein 2022-04-21 12:36 發表於浙江
2019年,地球村遭遇了新冠病毒的攻擊,新冠大魔王派出了Alpha、Gamma、Delta、Lambda、Omicron等毒株作為先鋒,試圖透過感染的方式佔領地球村。人類奮起反抗,利用新冠疫苗和科學的防疫手段保衛自己的家園。然而最近新冠大魔王透過幾種相關病毒共同感染同一個細胞的方式,將多個突變株重組整合,形成了毒性更強的XD(Delta和Omicron BA.1的重組體)、XE(Omicron BA. 1和BA.2的重組體)、XF(Delta和Omicron BA.1的重組體)等多種重組病毒。人類的家園保衛戰已經打響,那麼如何在擊退新冠大魔王的同時,盡量減少損失?

這時候,類器官兵團作為研究病毒-宿主相互作用的「替身」上場了,這個兵團由肺、腦、心臟、腎等多種類器官模型組成,其結構不僅保留了與體內器官高度相似的組織學、遺傳學特點,同時形成的組織有幹細胞增生與分化潛能。這些類器官主要用來取代人類進行體外模擬病毒感染實驗,進而對感染的標靶、候選藥物的篩選進行研究。

圖1. SARS-CoV-2感染的人體器官[1]
肺類器官
新型冠狀病毒感染主要涉及呼吸系統,透過唾液飛沫從一個人傳播到另一個人。在新冠肺炎陽性的病例中,87%患者的肺組織呈現典型的瀰漫性肺泡損傷特徵。
肺是一個具有高度分支的器官,傳統的肺細胞係不能夠準確反映出肺在體內的情況,而人類肺類器官包含各種細胞類型,這些細胞在空間組織和功能上類似於胎兒的肺組織,Paola Spitalieri等人[2]透過在體外模擬人類胎兒肺器官發育成熟的過程,成功地製備出了可長期培養的人類肺類器官(hLORGs),目前正在應用該模型進行細胞嗜性、宿主細胞反應、影響病毒易感性的遺傳變異、新型候選藥物等多項研究。
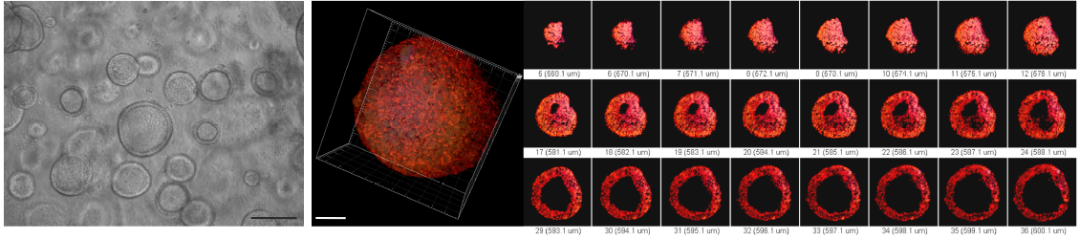
圖2. 體外培養用於SARS-CoV-2感染的人類肺類器官模型(hLORGs)[2]
腦類器官
大量病例報告表明,新冠肺炎可以表現出暫時或完全喪失嗅覺功能,並且已經在患者腦樣本中檢測到病毒RNA,這些報告表明新型冠狀病毒具有嗜神經性特徵。目前腦類器官正在新冠感染機制研究中大放異彩。Eric Song等人[3]在2020年發現,SARS-CoV-2感染人類腦類器官後,能夠觀察到明顯的感染現象,並且伴隨著感染神經元和鄰近神經元的代謝變化;同時證明了阻斷ACE2抗體後可以預防神經元感染。Jacob等人[4]發現了在感染新冠病毒的腦類器官模型中,炎症信號相關基因的表達上調;Wang等人[5]利用腦類器官模型確定了新冠肺炎的一個重要致病因子: ApoE4 。
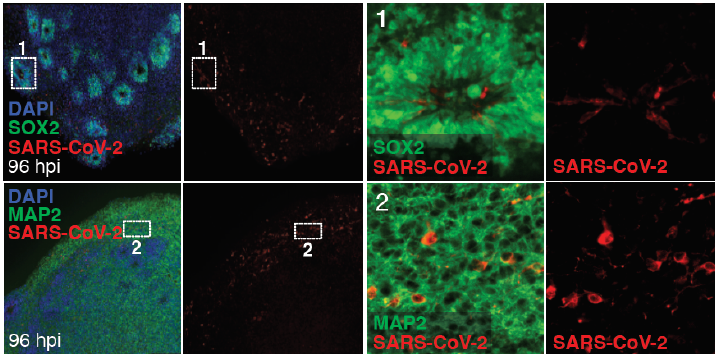
圖3. SARS-CoV-2感染人類腦類器官後,隨著時間延長,SARS-CoV-2陽性細胞增多[3]。
消化道類器官
新冠肺炎患者也表現出各種胃腸道症狀,包括腹瀉、噁心、嘔吐、厭食和腹痛。單細胞分析表明,ACE2和TMPRSS2在迴腸和結腸中均有表達,而在小腸中ACE2的表達量最高。Clevers小組[6]在人類AdSC衍生的腸類器官樣本中觀察到了被SARS-CoV-2感染的情況,再次強調了類器官能夠在體外快速、有效率地重現病毒感染過程。Mithal等人[7]找出了人類腸道類器官可以被病毒感染及活化幹擾素相關的基因,包括BST2、OASL、MX1、IFITM1和IRF7。這些基因的發現為後續的藥物研發提供了強而有力的依據和研究的方向。
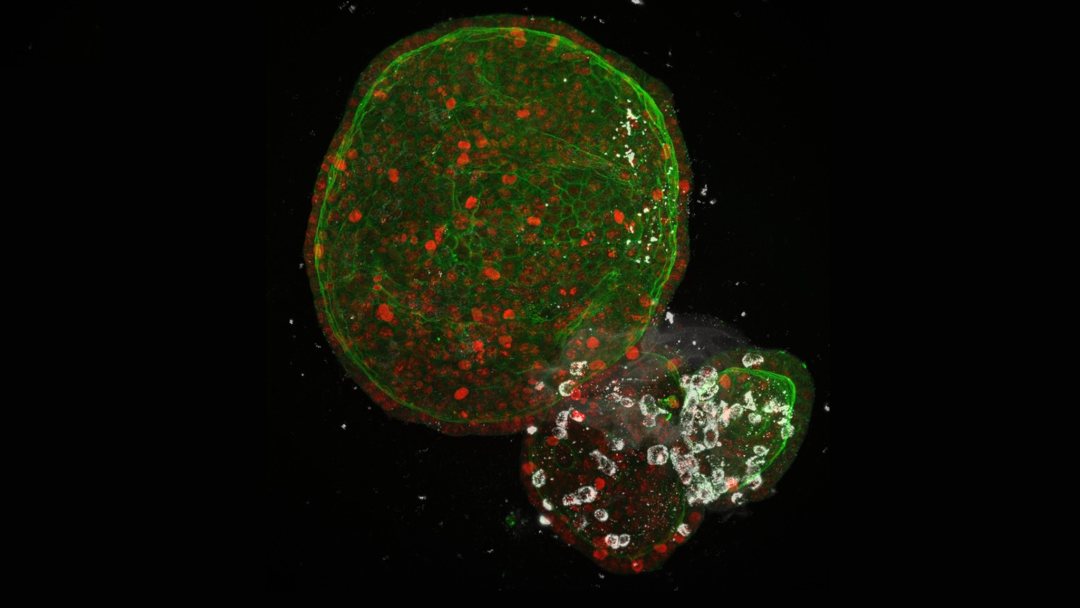
圖4. 感染SARS-CoV-2的人體腸道類器官(白色)(圖片來源: Joep Beumer/Clevers group/Hubrecht Institute)
其它類器官
新冠肺炎研究中也會使用其它相關類器官,包括腎臟、視網膜、血管和肝臟類器官。
在對新冠肺炎的第一批研究中,Monteil 等人[8]證明了新型冠狀病毒可以直接與血管和腎臟類器官相互作用,並且這種相互作用可以透過臨床級可溶性ACE2治療來阻斷。Yang等人[9] 已證明人類肝臟類器官和膽管類器官也易受新型冠狀病毒感染,且趨化因子的誘導模式與在患者樣本中發現的模式相似。
類器官模型協助新冠藥物開發
新冠肺炎是一種新的疾病,致病機轉仍需進一步研究,開發有效藥物仍是研究工作重點。
研究人員透過類器官模型,已找到了多個與新冠感染相關的蛋白,對它們進行了結構功能性研究、藥物設計和篩選。藥品研發主要從以下四個方面進行:一是抑制病毒進入細胞,如透過中和抗體對病毒表面的刺突糖蛋白進行封閉;二是抑制病毒蛋白酶活性,如PL、3CL蛋白酶抑制劑,阻止病毒的轉錄、翻譯;三是透過抑制與病毒複製相關的RNA聚合酶而具有抗病毒活性,如瑞德西韋(Remdesivir)就是抑制病毒RNA複製、轉錄的一種核苷酸類似物;四是抑制病毒融合、包裝、轉運,如弗林蛋白酶(Furin)抑制劑、跨膜絲胺酸蛋白酶(TMPRSS2)抑制劑。目前,治療新冠肺炎的藥物基本上採用「老藥新用」策略,在安全的基礎上,根據藥物作用機理,合理推測疾病適應症。

類器官培養系統
類器官的形成需要單細胞或小細胞群增殖並重組,成為複雜的、有組織的細胞團,以模擬特定器官的一些結構和功能特徵。雖然幹細胞具有分化的特性,但是要如何將各個細胞分化成為理想的細胞類型呢?答案就是細胞激素。不同種類的類器官培養過程中所需的細胞因子略有差異,透過添加促進或抑制特定訊號路徑的因子,將培養物導向感興趣的細胞譜系。例如:肺類器官的培養需要添加Activin A、FGF basic、FGF-4、Noggin;而前列腺類器官則需要添加EGF、Activin A、FGF basic、FGF-10、Noggin。
近岸蛋白自主研發的低內毒素Activin A、EGF、FGF basic、R-Spondin 1、Noggin、Wnt3a等細胞因子,內毒素低至<10EU/mg,具有高活性、高純度、高批間一致性,為類器官培養設計,已獲得市場認可,讓您研究放心!
常見類器官培養相關細胞因子
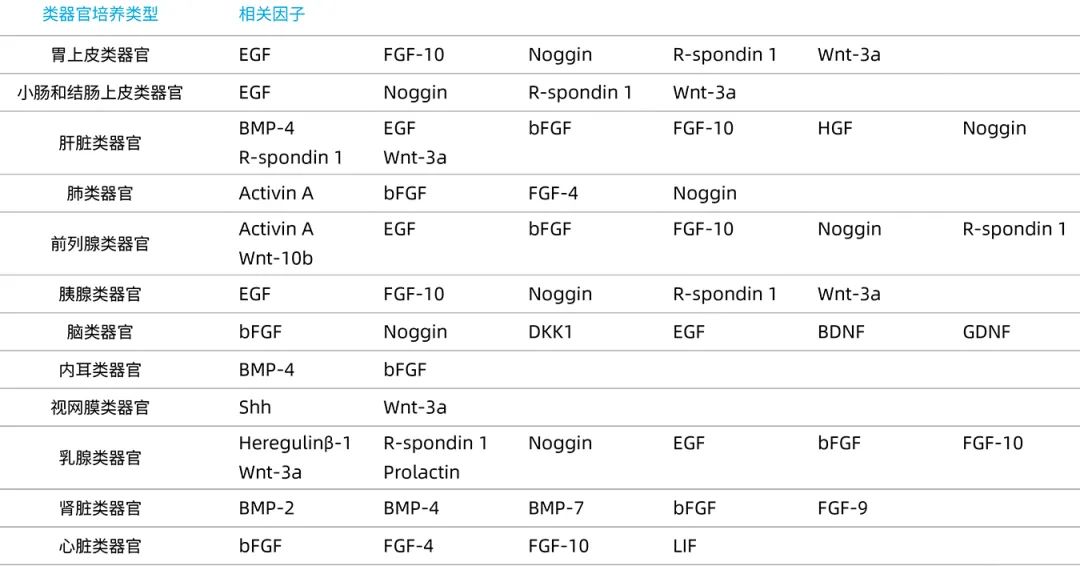
Novoprotein自主研發生產並經過類器官培養驗證的低內毒素Wnt3a、R-Spondin 1、Noggin、 FGF-10、FGFb和Shh等細胞因子,內毒素低至<10EU/mg,具有高活性、高純度、高批間一致性,為類器官培養設計,已獲得市場認可,讓您研究放心!
| 貨號 | 產品名稱 |
| C687 | Human/Mouse/Rat Activin A |
| C076 | Human/Mouse/Rat BDNF |
| C012 | Human/Mouse/Rat BMP-2 |
| C688 | Human DKK1 (N-8His) |
| C029 | Human EGF |
| CH28 | Mouse EGF (C-6His) |
| C779 | Human FGF basic/FGF-2/bFGF |
| C044 | Mouse FGF basic/FGF-2/bFGF |
| CR08 | Human FGF-4 |
| CR66 | Mouse FGF-4 |
| CH73 | Human FGF-7/KGF |
| C198 | Human FGF-9 |
| CR12 | Mouse FGF-9 (N-6His) |
| CR11 | Human FGF-10 |
| C226 | Human GDNF |
| CJ72 | Human HGF (C-6His) |
| CC13 | Mouse HGF (C-6His) |
| C017 | Human LIF |
| C690 | Mouse LIF |
| CB89 | Human Noggin |
| C028 | Mouse Noggin(C-6His) |
| C753 | Human NRG1-beta 1 |
| C736 | Human Prolactin/PRL |
| CX83 | Human R-Spondin 1 (C-6His) |
| CB79 | Human R-spondin 3 (C-Fc-6His) |
| C100 | Human Shh |
| C089 | Human Shh (C24II) |
| CH69 | Mouse Shh |
| CH66 | Mouse Shh(C25II) |
| C06D | Human Wnt3a |
參考文獻
1. HAN, Yuling, et al. Human organoid models to study SARS-CoV-2 infection. Nature Methods , 2022, 1-11.
2. SPITALIERI, Paola, et al. Two Different Therapeutic Approaches for SARS-CoV-2 in hiPSCs-Derived Lung Organoids. Cells , 2022, 11.7: 1235.
3. SONG, Eric, et al. Neuroinvasive potential of SARS-CoV-2 revealed in a human brain organoid model. 2020.
4. JACOB, Fadi, et al. Human pluripotent stem cell-derived neural cells and brain organoids reveal SARS-CoV-2 neurotropism predominates in choroid plexus epithelium. Cell stem cell , 2020, 27.66:99.699.
5. WANG, Lu, et al. A human three-dimensional neural-perivascular 'assembloid'promotes astrocytic development and enables modeling of SARS-CoV-2 neuropathology. Nature medicine , 2021, 270.9: 160.
6. LAMERS, Mart M., et al. SARS-CoV-2 productively infects human gut enterocytes. Science , 2020, 369.6499: 50-54.
7. MITHAL, Aditya, et al. Human pluripotent stem cell-derived intestinal organoids model SARS-CoV-2 infection revealing a common epithelial inflammatory response. Stem cell reports , 2021, 16.4: 3.
8. Monteil V,Kwon H,Prado P,et al. Inhibition of SARS-CoV-2 Infections in Engineered Human Tissues Using Clinical-Grade Soluble Human ACE2[J].Cell,2020,S0092-8674(20)3039-8 .
9. YANG, Liuliu, et al. A human pluripotent stem cell-based platform to study SARS-CoV-2 tropism and model virus infection in human cells and organoids. Cell stem cell , 2020, 27.1: 127.
