一文詳解幹細胞培養的細胞外基質(ECM)
Novoprotein 2023-08-17 14:35 發表於浙江
在體內環境中,每一種細胞都生存在自己獨特的生態位中,如細胞粘附分子(Cell adhesion molecules,CAMs)通過多種機制實現細胞間以及細胞與細胞外基質(Extracellular matrix,ECM)之間的相互作用,這些相互作用由受體、激素、生長因子介導,促進廣泛的細胞信號傳導過程,直接或間接調節幹細胞增殖、黏附、自我更新特性和多譜系分化。ECM的主要成分是膠原蛋白、糖蛋白(層粘連蛋白、玻連蛋白和纖連蛋白等)和蛋白聚醣[1]。ECM通過激活信號通路而對細胞的黏附、功能和組織穩定至關重要,這些信號通路通過與細胞表面受體(主要是整合素)結合而激活。在大多數情況下,幹細胞是通過使用未定義的接觸表面和異種成分來培養的。然而,幹細胞在組織再生和細胞治療中的有效穩定應用需要提供化學定義、成分明確、非異種、可複現和可擴增的培養條件。因此,在幹細胞培養體系中額外加入ECM的特定成分能夠穩定可控地為乾細胞提供必要的生存環境。
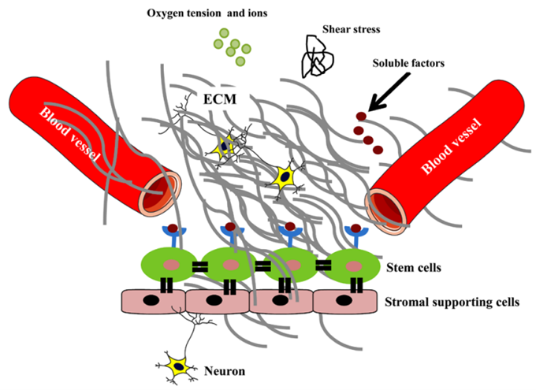
圖1.幹細胞生態位的組成[2]
基質膠(Matrigel)
基質膠是一種從EHS小鼠肉瘤細胞中分離出來的膠狀基底膜提取物,由多種ECM蛋白(層粘連蛋白、膠原IV、纖連蛋白、硫酸肝素和entactin)、生長因子和蛋白聚糖組成[3],可以非常有效地維持幹細胞的增殖並支持後續分化,但基質膠培養體系存在致病性污染的可能性,並且批次之間的差異較難控制,使其在再生醫學和細胞治療中的應用存在風險和不穩定因素。
玻連蛋白(Vitronectin)
玻連蛋白是一種存在於血清和ECM中的小分子量糖蛋白,能夠促進細胞黏附、伸展和遷移。玻連蛋白可以與整合素αvβ5和αvβ1相互作用[4],能夠維持幹細胞的多能性、正常核型和體外分化的能力[5, 6]。在多能幹細胞培養中可以有效地代替Matrigel,維持細胞增殖和正常的細胞特性。
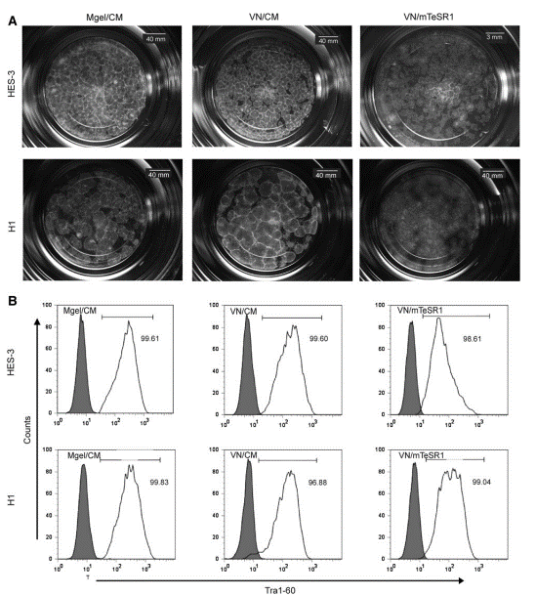
圖2.Vitronectin可以維持人多能幹細胞的生物學特性[7]
纖連蛋白(Fibronectin)
纖連蛋白是廣泛分佈的一種大分子量細胞外糖蛋白,由於纖連蛋白具有多個結合域,使其能夠與ECM蛋白和CAMs結合,從而調控不同的信號通路,並最終參與細胞遷移、黏附、增殖、胚胎生成和傷口癒合等生物學過程,作為多能幹細胞培養基質時,可以促進細胞生長,提高細胞貼壁率,增強細胞代謝水平,促進乾細胞的自我更新,並可在特定的培養體系中促進乾細胞向心肌細胞、胰島細胞等分化[8, 9]。

圖3.Fibronectin在hPSC 心臟分化開始時至關重要[8]
層粘連蛋白(Laminin)
層粘連蛋白是一種十字形三聚體蛋白,含有α、β和γ鏈,被認為是基底膜的主要成分[10]。由於層粘連蛋白具有多種細胞結合基序,可以與細胞整合素和蛋白聚醣結合,激活FAK、AKT、YAP等信號通路,從而調節多能幹細胞的自我更新,分化和多能性[11 , 12]。層粘連蛋白亞型的命名是基於它們鏈的組成,例如,由α5、β2和γ1三條鏈組成的異源三聚體糖蛋白被稱為Laminin-521;α5,β1和γ1的組合被稱為Laminin-511。Laminin-521和511是最早表達的胞外蛋白,在胚胎2-4細胞期就已經可以檢測到,這也為它維持多能幹細胞增殖和特異性分化提供了潛能。與Matrigel相比,Laminin-511具有更好的粘附多能幹細胞能力和相似的自我更新特性[13],且能提高完全解離後的細胞存活率,而纖連蛋白和玻連蛋白不能維持游離細胞的存活。
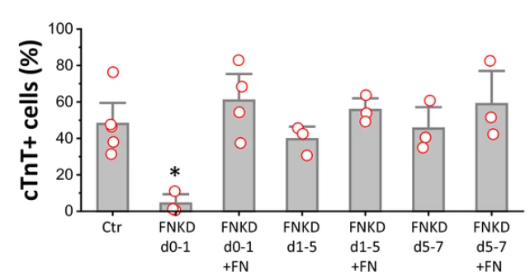
圖4.Fibronectin、Laminin可以維持人多能幹細胞的生物學特性[13-15]
Novoprotein 提供一系列經驗證的高活性基質蛋白,滿足不同的幹細胞培養需求!
| Cat. No. | Product Name |
| C395 | Recombinant Human Vitronectin |
| GMP-C395 | Recombinant Human Vitronectin, GMP Grade |
| CH38 | Recombinant Human NovoNectin ®(Fibronectin) |
| GMP-CH38 | NovoNectin ® GMP Grade(Fibronectin) |
| CR98 | Recombinant Human Vitronectin |
| C28C | Recombinant Human Laminin511 E8 Protein |
| C28D | Recombinant Human Laminin521 E8 Protein |
參考資料
[1] Hynes R O. The extracellular matrix: not just pretty fibrils[J]. Science, 2009, 326(5957): 1216-1219.
[2] Abdal Dayem A, Lee S, HYC, et al. The Impact of Adhesion Molecules on the In Vitro Culture and Differentiation of Stem Cells[J]. Biotechnol J, 2018, 13(2).
[3] Kleinman HK, Mcgarvey ML, Liotta LA, et al. Isolation and characterization of type IV procollagen, laminin, and heparan sulfate proteoglycan from the EHS sarcoma[J]. Biochemistry, 1982, 21(24): 6188-6193.
[4] Felding-Habermann B, Cheresh D A. Vitronectin and its receptors[J]. Curr Opin Cell Biol, 1993, 5(5): 864-868.
[5] Braam SR, Zeinstra L, Litjens S, et al. Recombinant vitronectin is a functionally defined substrate that supports human embryonic stem cell self-renewal via alphavbeta5 integrin[J]. Stem Cells, 2008, 26(9): 2257- 2265.
[6] Rowland TJ, Miller LM, Blaschke AJ, et al. Roles of integrins in human induced pluripotent stem cell growth on Matrigel and vitronectin[J]. Stem Cells Dev, 2010, 19(8): 1231-1240.
[7] Yap LY, Li J, Phang IY, et al. Defining a threshold surface density of vitronectin for the stable expansion of human embryonic stem cells[J]. Tissue Eng Part C Methods, 2011, 17(2): 193- 207.
[8] Zhang J, Gregorich ZR, Tao R, et al. Cardiac differentiation of human pluripotent stem cells using defined extracellular matrix proteins reveals essential role of fibronectin[J]. Elife, 2022, 11.
[9] Lin HY, Tsai CC, Chen LL, et al. Fibronectin and laminin promote differentiation of human mesenchymal stem cells into insulin producing cells through activating Akt and ERK[J]. J Biomed Sci, 2010, 17(1): 56 .
[10] Aumailley M. The laminin family[J]. Cell Adh Migr, 2013, 7(1): 48-55.
[11] Vachon P H. Integrin signaling, cell survival, and anoikis: distinctions, differences, and differentiation[J]. J Signal Transduct, 2011, 2011: 738137.
[12] Zhang D, Yang S. Niche-derived laminin-511 promotes midbrain dopaminergic neuron survival and differentiation through YAP[J]. 2017, 10(493).
[13] Rodin S, Domogatskaya A, Ström S, et al. Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511[J]. Nat Biotechnol, 2010, 28(6): 611-615.
[14] Xu C, Inokuma MS, Denham J, et al. Feeder-free growth of undifferentiated human embryonic stem cells[J]. Nat Biotechnol, 2001, 19(10): 971-974.
[15] Baxter MA, Camarasa MV, Bates N, et al. Analysis of the distinct functions of growth factors and tissue culture substrates necessary for the long-term self-renewal of human embryonic stem cell lines[J]. Stem Cell Res, 2009, 3(1): 28-38.
