類器官課堂-控糖有一套
Novoprotein 2023-07-26 18:33 發表於浙江
胰腺是分泌血糖穩態激素的重要器官,是人體內控制血糖動態平衡的中心。胰腺的內分泌功能主要是由胰島來完成的,每個胰島都是一個複雜的微器官,由上千個分泌細胞組成。經典的胰島內分泌細胞包括α細胞、β細胞、δ細胞、ε 細胞和PP細胞,分別主要產生胰高血糖素(glucagon)、胰島素、生長抑素(SS)、生長素釋放肽及胰多肽,其在成體胰島內分別約佔20%、75%、3%~5%、1%和<2% 【1】。
胰島移植為I型和晚期II型糖尿病患者提供了卓越的長期血糖控制方案,但是成體胰島組織的可用量限制了這一治療方案的廣泛應用。目前誘導多能幹細胞(iPSC)分化為產生胰島素的β樣細胞是一項重大進展。2021年美國食品和藥物管理局(FDA)已授予VX-880(一種iPSC細胞在體外誘導分化而來的胰島β細胞)快速通道資格,目前已啟動VX-880的臨床試驗,用於治療嚴重低血糖和低血糖意識受損的1型糖尿病(T1D)患者。在2023年6月舉辦的美國糖尿病協會(ADA) 第83屆科學會議上公佈了正在進行的VX-880臨床試驗的積極結果:所有接受VX-880治療的患者均在治療前一年內檢測不到胰島素的分泌,且有反復發生嚴重低血糖事件(SHE) 的病史;治療後,所有6名患者均表現出胰島素分泌恢復、血糖控制改善、時間範圍改善、外源性胰島素使用減少或消除,並且在第90天后的評估期間完全沒有發生不良反應【2】。
類器官是一項新興技術,與動物模型相比,類器官可以完全是人類細胞來源的;與人源器官相比,類器官更容易獲得,並且可以定向分化;與組織來源的原代細胞相比,類器官獨有的多細胞類型和三維培養模式,能夠更好地模擬體內的結構和功能【3】。
本篇文章基於Nature Communications 【4-5】和Cells 【6】發表的三篇文章,整理了人多能幹細胞(hPSC)來源的胰島樣類器官培養方案。該培養過程遵循發育原理,由hPSC 依次分化為定型內胚層(DE)、胰腺祖細胞(PP)、內分泌前體(EP), 最終誘導發育為人胰島樣類器官(human Islet-like Organoid, hILO) 。
.png)
圖1.幹細胞生態位的組成[2]
細胞來源
hPSCs
培養試劑配方
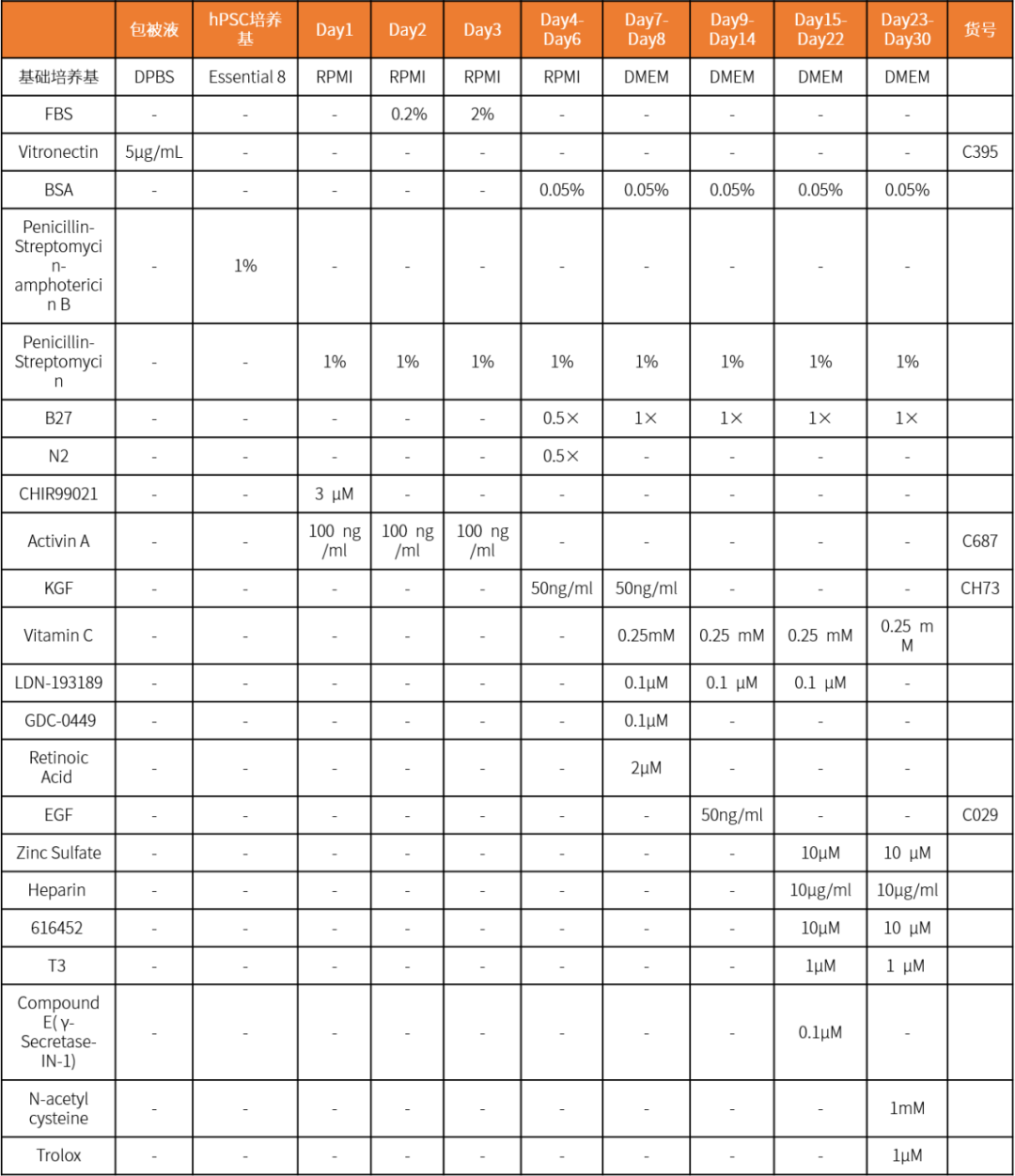
一、hPSC培養
1. 將hPSC接種在Vitronectin包被的6孔板上,加入hPSC培養基進行擴增培養。
2. 傳代時加入Accutase,將hPSC消化成單細胞。
3. 用DPBS清洗兩次後,接種到用Vitronectin包被的12孔板中,接種密度為1.0 × 104個細胞/cm2。
4. 在傳代培養的第一天加入含10 mM Y-27632的hPSC培養基,之後用hPSC培養基換液。37℃,5% CO2培養48小時。
5. 用DPBS清洗兩次後,進入後續的分化步驟。
二、誘導形成胰島樣類器官
6. 每天按照對應的培養基換液,培養到第15天時細胞聚成懸浮的小球。
7. 繼續按照對應的培養基換液,37℃,5% CO2繼續培養至30天。
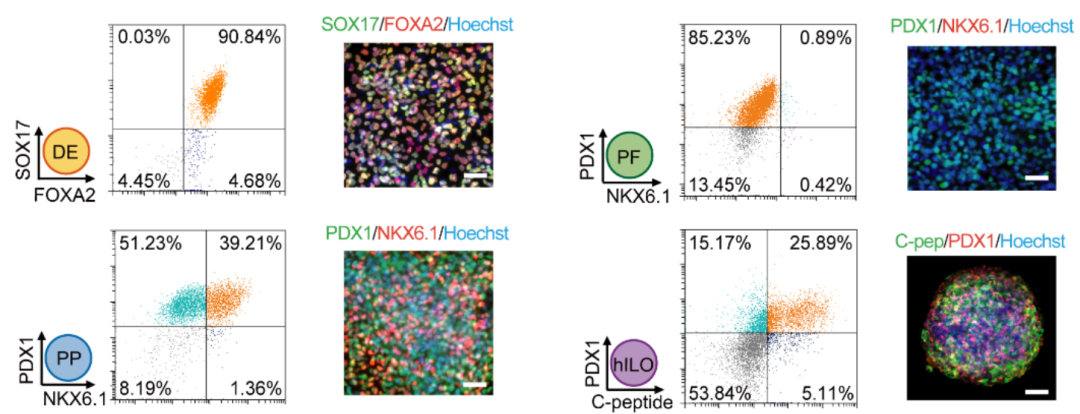
圖2. 流式和免疫螢光鑒定。hPSC誘導形成的DE、PF、PP和hILO能夠正常表達各自的標記物【4】。尺規,100 μm
可用於醫學研究的胰島樣類器官
隨著技術的不斷進步,胰島樣類器官的發育和功能越來越接近生理條件下的胰島組織,胰島樣類器官可以在某些場景下作為人類胰島的替代品。
長期以來,由於動物模型不能完全類比人的疾病特徵,糖尿病研究一直缺乏真實的疾病模型。基於幹細胞的胰島樣類器官忠實地模擬了胰島的發育過程【8】,並具有與天然胰島相似的形態結構和細胞組成。將基因編輯技術(如CRISPR/Cas9)和iPSC分化技術的結合,能夠通過操縱胰島樣類器官來研究正常和糖尿病人胰島的發育【9】、功能和病理機制,在促進藥物篩選和自體胰島移植方面具有巨大前景。
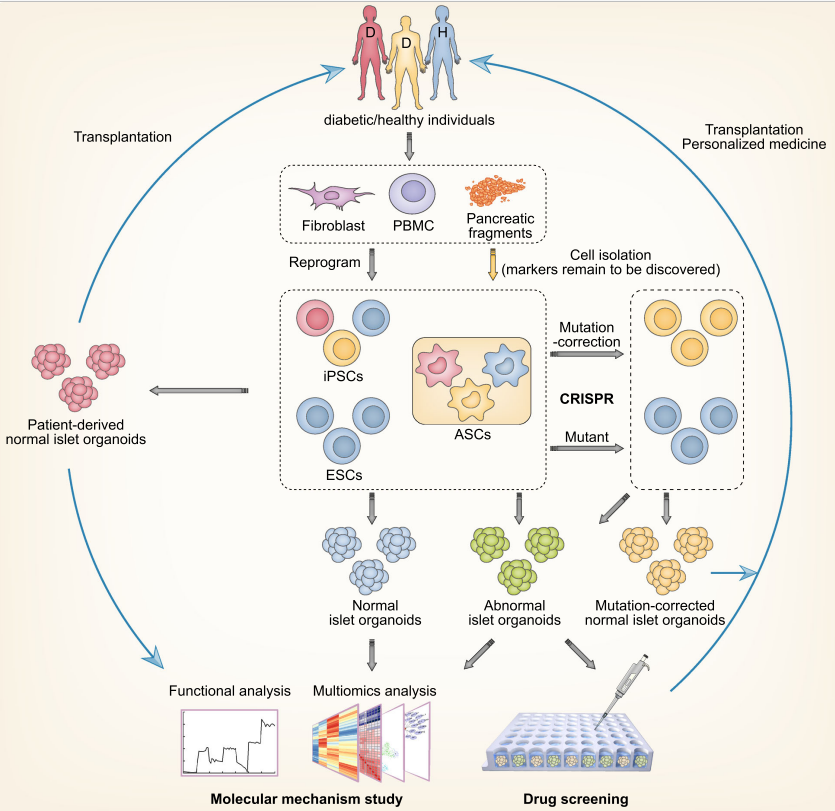
圖3. 胰島樣類器官在發育機制、疾病建模和個性化醫療中的應用前景【7】
Novoprotein自主研發生產並經過類器官培養驗證的低內毒素Activin A、FGF系列、HGF、R-Spondin 1、Noggin和Wnt3a等細胞因數,內毒素低至<10EU/mg,具有高活性、高純度、高批間一致性,為類器官培養設計,已獲得市場認可,讓您研究放心!
推薦產品-胰島樣器官
參考資料
【1】Zeng Z, Huang B, Parvez R K, et al. Generation of patterned kidney organoids that recapitulate the adult kidney collecting duct system from expandable ureteric bud progenitors[J]. Nature Communications, 2021, 12(1): 3641.
【2】Nishita M, Qiao S, Miyamoto M, et al. Role of Wnt5a-Ror2 signaling in morphogenesis of the metanephric mesenchyme during ureteric budding[J]. Molecular and cellular biology, 2014, 34(16): 3096-3105.
【3】Taguchi A, Nishinakamura R. Higher-order kidney organogenesis from pluripotent stem cells[J]. Cell stem cell, 2017, 21(6): 730-746. e6.
【4】Taguchi A, Kaku Y, Ohmori T, et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells[J]. Cell stem cell, 2014, 14(1): 53-67.
【5】Oldershaw R A, Baxter M A, Lowe E T, et al. Directed differentiation of human embryonic stem cells toward chondrocytes[J]. Nature biotechnology, 2010, 28(11): 1187-1194.
【6】Geuens T, van Blitterswijk C A, LaPointe V L S. Overcoming kidney organoid challenges for regenerative medicine[J]. NPJ Regenerative medicine, 2020, 5(1): 8.
