類器官培養100問-上篇50問(1)
Novoprotein 2023-06-15 18:42 發表於上海
類器官是能夠在體外三維培養,並表現出相應器官生物學特徵的“最小系統”。雖然對於類器官的研究日趨成熟,但大家總會有這樣那樣的小困惑:為什麼要用上皮細胞培養?為什麼培養基的成分這麼複雜?
Novoprotein憑藉構建類器官平臺的實踐經驗和深厚的文獻積累,圍繞類器官培養基本操作(基礎篇),腫瘤類器官培養(PDO篇),以及類器官應用等多個主題方向,精心整理了類器官培養常見問題100問,今天為大家帶來上篇。
<< 基礎篇 >>
Q1: 類器官培養對於起始細胞的來源有要求嗎?
A1: 目前培養的類器官主要來源於上皮細胞,對於非上皮細胞來源的類器官培養方式還需要進一步研究。
Q2: 類器官按照起始細胞的類型,分為幾種呢?
A2: 常見的類器官根據起始細胞的類型,可以分為兩種:
(1)腫瘤組織來源的腫瘤類器官;
(2)幹細胞來源的類器官,包括:多能性幹細胞(PSC) /成體幹細胞(ASC)以及誘導多能幹細胞(iPSC)。
Q3: 類器官是由單一種類細胞組成的嗎?
A3: 類器官並不是單一細胞組成的結構,而是由具有乾細胞性質的起始細胞進行分裂和分化,並將多種類型的細胞自組裝的結構,自組裝後的形態和功能與體內相應器官相似。
Q4:在沒有新鮮組織的情況下,可以用凍存組織提取的原代細胞進行3D培養嗎?
A4:可以的。已有學者驗證過,將人結腸癌、甲狀腺癌、肺癌、腎癌和肝癌的手術組織切碎後,以梯度降溫的方式進行冷凍,最終在液氮中保存15-18個月後進行複蘇和原代細胞提取,分別對細胞進行2D和3D培養,證實了凍存對於細胞活力和生長速度均無顯著影響【1】。
當然,由於組織來源不同、凍存條件不同,還需要大家根據實際情況進行驗證,新鮮組織提取的細胞依然是3D培養的最佳選擇。
Q5:類器官可以像細胞一樣進行凍存和復蘇嗎?
A5:類器官可以凍存,通常會在傳代2-3次之後選擇凍存。為了達到最佳的效果,可以選擇類器官成熟(傳代7-10次)後再進行凍存。
Q6:類器官的尺寸需要進行控制嗎?
A6:是的,主要的原因是類器官內部缺乏循環系統。
當類器官的尺寸較大時,靠近中心的細胞難以和外界進行氧氣和營養成分的交換。因此這個結構尺寸越大,死亡的細胞就越多(見下圖)【2】。我們在培養的過程中,需要控制類器官的大小在4-5mm以內。未來的類器官技術可以與血管類器官結合在一起,建立一個功能性的封閉循環系統,用以培養出更大尺寸的類器官。
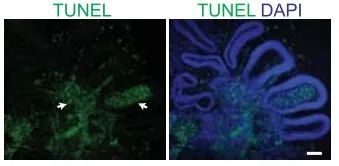
TUNEL染色表明較大尺寸的類器官中心有大量細胞死亡(綠色),比例尺為100μm 【2】
Q7:類器官傳代的標準是什麼?
A7:類器官的傳代通常是根據培養的時間判斷。一般在7-14天時進行第一次傳代,後續則每7-10天傳代一次【3】。
Q8:類器官可以進行多少次傳代?
A8:大部分類器官可以在體外連續傳代10次(>6個月),甚至有些類器官可以連續傳代20次(>12個月)並且維持原有的生長速度【4 】。
Q9: 鑑定類器官的方法有哪些?
A9: 初步可以通過顯微鏡和H&E染色觀察形態;然後可以用Western Blot、qRT-PCR、免疫螢光、流式細胞術檢測該類器官是否表達相應的biomarker;基因測序可以鑒定所培養的類器官是否有某些特徵丟失;對於部分類器官,還可以檢測其是否具有功能,例如:已有研究檢測出胃類器官可以分泌胃酸,心臟類器官可以自主跳動。
Q10: 類器官是如何按照我們的意願進行定向分化的?
A10: 在進行類器官培養前,我們需要瞭解該器官在體內的發育過程,及早期發育相關的信號通路。
以胃類器官培養為例:胃由前後腸發育而來,早期發育需要由多種信號通路共同調控。那麼在體外我們需要通過添加細胞因數的方式,指導啟動/抑制相應的信號通路,來達到相同的效果,如:PSCs在Activin A的作用下分化為內胚層,Wnt3a、FGF-4和Noggin指導細胞向向前腸分化【5】。患者來源類器官(Patient Derived Organoid, PDO)是體外評估藥物的有效模型,目前較常用于患者的個性化用藥和抗癌藥物的測試領域。今天小編整理了部分PDO培養中常遇到的問題,希望能夠對各位小夥伴有所幫助。
<< PDO篇 >>
Q11:對於病人的腫瘤組織,需要怎樣處理儘量避免污染?
A11:
1、 將腫瘤組織置於70%-75%乙醇中30秒,清洗表面血塊等雜物,並用剪刀對組織稍加修整。
2、 放入含有青/鏈黴素、兩性黴素B、慶大黴素(單獨使用某一種或幾種組合)的PBS緩衝液進行進一步清洗。
3、 原代細胞提取前,建議先進行支原體檢測,防止支原體污染。
Q12: PDO對於藥敏反應的準確度是怎樣的呢?
A12:有資料表明,PDO對藥敏反應的陽性預測值(預測某一特定藥物有效)為88%,陰性預測值(預測某一特定藥物無效)為100%,敏感性達100%,特異性為93%【6】。
Q13:病灶和癌旁培養出的類器官有差別嗎?腫瘤組織的取材部位有什麼要求?
A13:原發病灶和癌旁來源的腫瘤類器官是有差別的。
如:從形態上看,原發病灶來源的類器官比癌旁來源的類器官更具有侵襲性的結構【7】。
由於腫瘤具有異質性,因此類器官存在差異也是很常見的。如果想要儘量減小建模或藥物篩選的誤差,可以考慮多點位取材。
.png)
原發病灶來源的類器官比癌旁來源的類器官更具有侵襲性的結構【7】
Q14:PDO培養的成功率是多少?成功率和是否進行治療有關係嗎?
A14:不同類型來源的PDO成功率略有不同,大部分的PDO培養成功率在63%-70%左右【6】,並且臨床治療對於這個統計結果影響不大【8】。通過縮短樣本離體時間和操作步驟,可以適當提高成功率。
Q15:凍存多長時間內的組織可以用於類器官培養?
A15:對於凍存在-80℃的組織,6周之內復蘇並進行類器官培養是最佳選擇【9】。當然如果是保存在液氮中,保存的時間可以更久一些。
Q16:原代細胞提取時,通常會混有增殖非常迅速的成纖維細胞,應該怎樣快速去除呢?
A16:成纖維細胞主要有兩種去除方式:
1、鑒於成纖維細胞貼壁不牢的性質,可以採用反復貼壁的方式去除大部分成纖維細胞。
2、目前已有商用的成纖維細胞去除試劑,但是否會影響類器官的培養還需要
Q17:培養腫瘤類器官需要原始腫瘤組織的大小是多少?活檢樣本量足夠嗎?
A17:手術組織大概需要3顆黃豆大小以上,穿刺活檢樣本需要至少3針,內鏡活檢至少鉗取6顆以上。
Q18:從腫瘤組織中提取原代細胞後,發現細胞呈紅色,這是為什麼?
A18:紅色主要是由於腫瘤組織中的大量紅細胞所導致的。
首先,可以在拿到組織後儘量多清洗幾次,能夠去除大部分的紅細胞;
其次,可以使用商品化的紅細胞裂解液。紅細胞裂解液的原理是去除無核細胞,因此不會影響其他有核細胞的正常培養。
Q19:怎樣構建含有PDO的腫瘤微環境?
A19:目前構建含有PDO的腫瘤微環境主要有三種方式:
(I)將腫瘤組織經過物理或酶解分離後,在細胞外基質(Matrigel或BME)中進行類器官培養;同時分離外源性免疫細胞(通常來源於自體外周血或腫瘤組織),隨後與生長的類器官進行共培養。
(II)將腫瘤消化後形成的球狀組織與膠原蛋白混合,並接種到微流體培養裝置中,即腫瘤細胞與樣本中的固有免疫微環境共同培養,形成天然TME模型。
(III)將含有免疫細胞的腫瘤組織物理切割成組織碎片,在包被膠原蛋白凝膠的transwell小室中進行培養。凝膠的頂部暴露在空氣中,同時外皿中的培養基通過可滲透的transwell擴散到內皿中,形成氣-液交互介面(air–liquid interface, ALI)。腫瘤免疫微環境的類器官培養系統建立可參考“腫瘤微環境的類器官模型,助力耐藥腫瘤的治療”。
Q20:由於取到的腫瘤組織太小了,培養的類器官數目不足以進行後續的檢測。我可以將類器官傳代擴增嗎?
A20:對於腫瘤來源的類器官一般是不建議傳代的,因為傳代後的表型會和體內情況略有差異。文獻中的PDO一般會控制在2-3代【9】,最多不超過5代【10】。
如果細胞數目太少,傳代5次依然不能滿足測試需求,可以考慮將檢測的方式改變一下,比如從96孔板換成384孔板,甚至更小體系的微流控晶片。
Q21:腫瘤組織中會存在正常細胞嗎?怎麼去除這些正常細胞?
A21:即使是肉眼判斷為腫瘤的組織中,也會混有一部分正常細胞。因此在進行類器官培養前,可以先將原代細胞進行流式分選或磁珠分選,得到腫瘤細胞再進行類器官培養。
Q22: 正常細胞是否也會生長為類器官?腫瘤類器官培養時怎麼去除正常類器官?
A22:由於腫瘤組織中通常混有一些健康細胞,因此培養出的腫瘤類器官很有可能混雜了來源於正常上皮的類器官。為了得到更純的PDO,除了Q1中提到的對原代細胞進行處理外,也可以對類器官群進行“純化”,主要有以下三種途徑【6】。
1、利用正常類器官和PDO的形態不同,在鏡下進行手動篩選。圖1展示了胃類器官和腫瘤類器官的形態差異:正常的胃類器官呈球形,由單層上皮細胞組成,具有較大的管腔;而腫瘤類器官通常是囊狀,且有多層細胞形態。
.png)
正常胃類器官和腫瘤類器官的鏡下形態不同,比例尺300μm【6】
2、通過調節培養基中的組分進行篩選。如:大多數胃癌表現出TP53突變,這一突變使PDO表現出對Nutlin-3更耐受,而正常類器官則會死亡。
.png)
3、將類器官消化為單個細胞後,流式分選出腫瘤細胞。
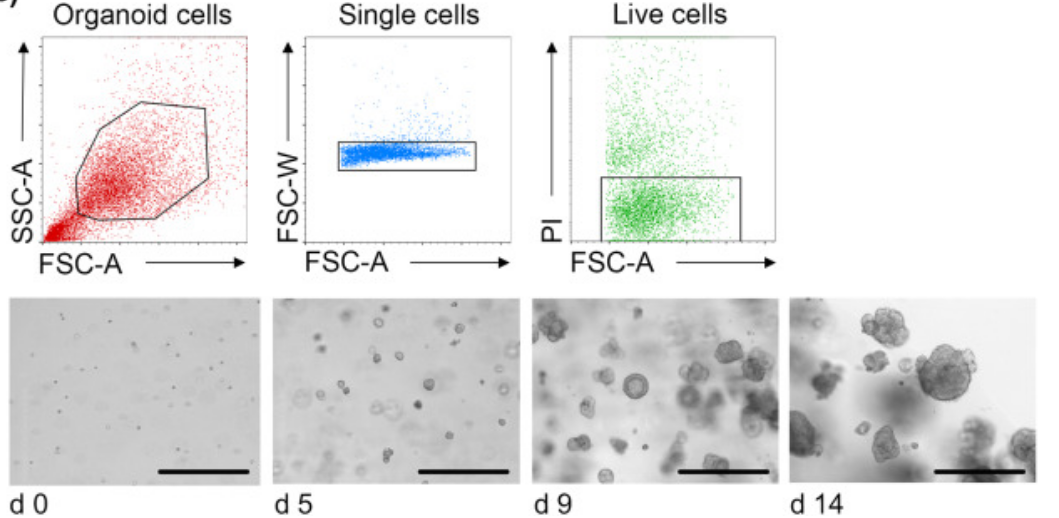
腫瘤類器官的單細胞流式分選,比例尺400 μm【6】
Q23:進行藥敏實驗時,需要將PDO從基質膠中消化下來嗎?
A23:可能有很多小夥伴擔心基質膠會阻礙藥物進入到PDO中,但無數實驗已經證明,基質膠內的PDO是可以對藥物進行回應的;而且PDO需要三維結構才能類比體內狀況,如果沒有了基質膠的支撐,藥敏實驗的準確性會打折扣。
Q24:PDO實驗可以代替動物模型(PDX)嗎?
A24:PDO相較於動物模型有很多優點,例如成本低、耗時短、可以進行大規模培養和實驗等。不過在藥物代謝、癌症的浸潤、轉移等方向的研究則需要動物實驗來進行。
Q25:在培養過程中,PDO生長情況與之前相比異常,主要表現為生長週期變短,增殖迅速,這是什麼原因?
A25:如果PDO在培養過程中突然增殖迅速,可能是某些雜質細胞(如成纖維細胞)的大量生長導致的,此時最好進行切片染色,觀察一下是否存在這些細胞的污染。如果不是這個原因,則考慮是突變引起的,最好進行測序驗證並與初代PDO進行比對。
Q26:怎樣檢測PDO對藥物的敏感性?
A26:主要有兩種途徑進行檢測。
1、進行細胞活力檢測,即線粒體呼吸(耗氧率)、糖酵解 (H+濃度)等;
2、可以通過高內涵成像技術進行分析。
Q27:PDO和腫瘤原代細胞的藥敏實驗濃度範圍相同嗎?
A27:小編查閱了大量的相關文獻,發現PDO的藥物測試有效濃度會整體高於2D細胞,不同種類的PDO之間也存在很大的倍數差異。
Q28:PDO模型可以進行抗體類藥物篩選嗎?
A28:由於抗體類藥物需要免疫細胞的參與,因此單純的PDO模型並不適合。可以考慮在PDO的基礎上建立腫瘤微環境(TME),從而進行抗體類藥物的測試。
Q29:腫瘤細胞系(如Hela細胞系)可以培養成為PDO嗎?
A29:不可以。PDO需要依賴多種細胞在體外的自組裝形成,而腫瘤細胞系沒有自組裝的能力,可能會形成細胞團,但這並不是PDO。
Q30:PDO可以進行建庫嗎?
A30:不論是原髮型還是轉移型腫瘤,都可以建立PDO樣本庫。但考慮到PDO的培養並不是百分之百成功的(比如CRC-PDO的培養成功率大約是73%【12】),因此建庫所需的樣本量會比較大。
<< 應用篇>>
類器官是能夠在體外三維培養,並表現出相應器官生物學特徵的“最小系統”。隨著類器官培養技術的不斷進步,應用也越來越廣泛。今天小編整理了一些關於類器官應用方面的問題,希望能夠對各位小夥伴有所幫助。
Q31:用於疾病研究的類器官需要最大限度減小差異。但在實際培養過程中,同批次類器官個體之間、以及不同批次類器官樣本之間均存在顯著差異,這個問題怎樣克服呢?
A31: 類器官是由不同類型的細胞組成的結構,並且在體外是自組裝的,因此很容易存在同一樣本在相同培養條件下的孔間差異。
如果是用於患者個性化醫療的腫瘤類器官,需要更精准地類比患者體內的特徵,這種情況建議採用多個平行來減小差異;
如果是用於機制研究或用作疾病模型的類器官,可以考慮利用“微流控液滴技術”進行工程化培養,相關成果已發表在Cell Reports Medicine【13】。
Q32: 目前培養出的類器官可以進行體內移植,用於器官重建嗎?
A32:已有動物實驗證實過可行性,比如:腸類器官移植小鼠治療潰瘍性結腸炎【14】;胰島類器官移植小鼠治療糖尿病【15】。
雖然目前類器官移植尚未進入臨床,但在2021年2月,Science【16】首次報導了利用膽道類器官修復離體條件下的人類肝臟,實現了膽道再生,並改善了膽汁性質。
Q33:類器官一般長到什麼程度可以用來進行藥物測試?
A33:這個問題可以在Nature Protocols【17】找到答案。
對於新鮮培養的類器官:建議對低代次類器官(2-3代)進行藥物篩選,以最大限度地減少使用過的培養基或體外突變累積對藥物測試的影響。
對於經過凍存的類器官:由於冷凍/解凍可能導致復蘇時器官樣形態的變化,因此建議類器官至少傳代一次再進行藥物篩選。如果出現復蘇後細胞活力不佳,則需要延長培養時間以恢復細胞狀態。
Q34:類器官建立是否成功有怎樣的標準嗎?
A34:1、判斷形態。顯微鏡下類器官形態可能為空泡狀、出芽狀、緊密型、鬆散型等,但整體形態一致。
2、可以鑒定相應的biomarker是否有表達,及分佈是否與組織切片相似。
3、是否能夠傳代3次以上,並可以凍存復蘇。
4、如果有條件的話,可以進行測序分析。
Q35:類器官可以進行基因編輯嗎?
A35:可以,幹細胞來源類器官的基因編輯多用於疾病建模,而腫瘤來源的類器官則多用於尋找疾病相關突變點或治療靶點,下圖列舉了類器官基因編輯的部分研究和應用。
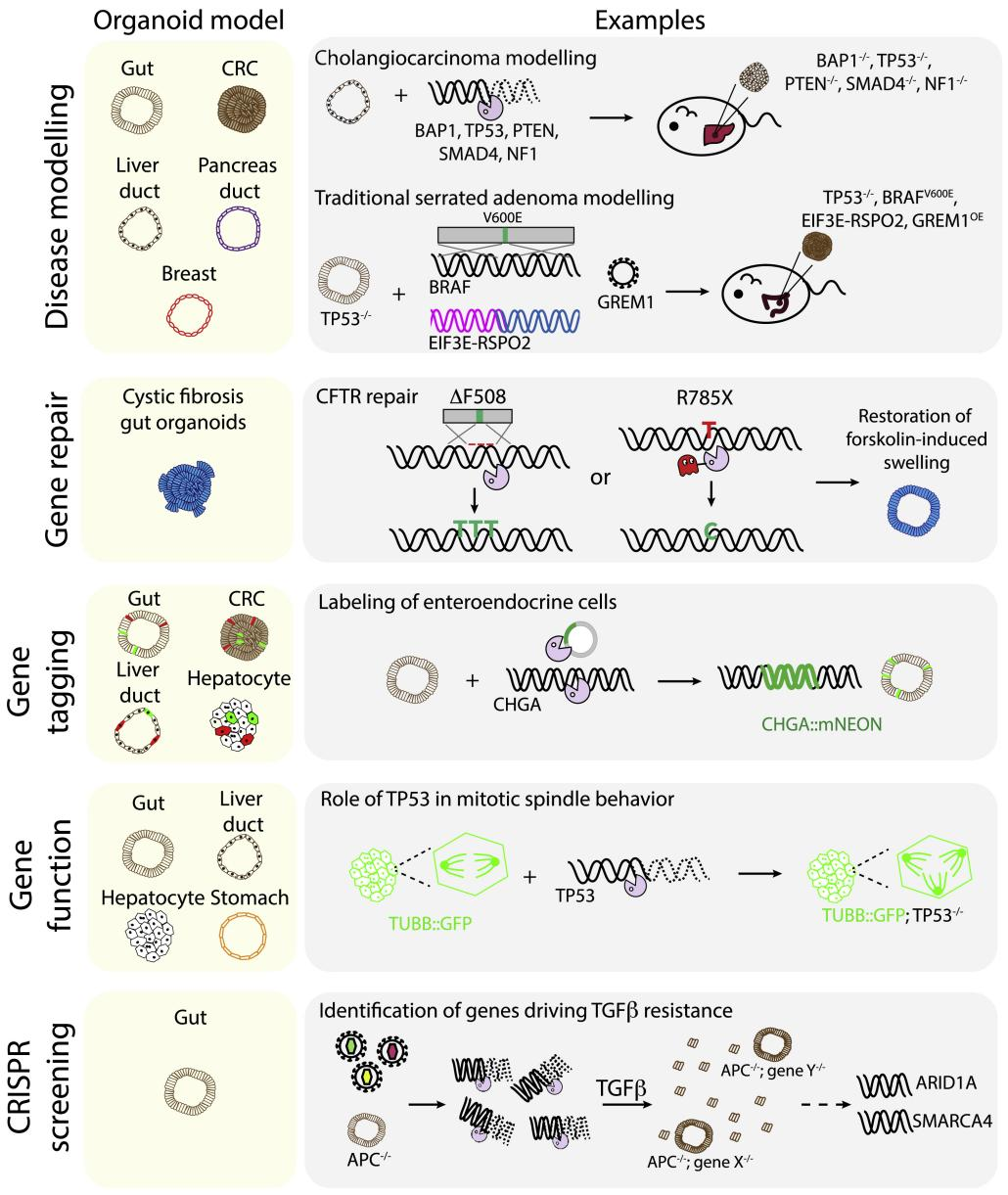
類器官基因編輯的部分研究和應用【18】
Q36:類器官培養和普通細胞培養有何不同之處?
A36:1、細胞來源有區別:類器官的細胞來源是具有多能性的上皮細胞,而普通細胞培養適用于培養多種類型細胞;2、 細胞培養方式不同:1)類器官需要基質膠等材料支撐其三維結構,普通細胞培養則不需要;2) 類器官需要實現體外分化和自組裝,因此需要多種細胞因數的組合進行誘導,培養基成分複雜。而普通細胞培養通常為單一種類細胞,因此培養基成分較簡單;
Q37:用哪種培養基培養來自轉移部位腫瘤的類器官,比如原發灶為A類型腫瘤,轉移灶為B類型腫瘤?
A37:通常來講,如果腫瘤發生了轉移,我們依然選用相對應的原發灶(A類型)PDO培養基。
Q38:怎樣證明培養出的結構是類器官,而不是簡單聚集在一起的細胞團?
A38:類器官的分化方式本質上是在類比體內的器官發育,因此表達形態及各細胞分佈情況與實際器官具有相似性,而細胞團則沒有這種規律。我們可以通過免疫螢光的方式檢測biomarkers的分佈情況來區分。例如下圖中的結果表明,腎類器官與腎組織的biomarkers分佈高度一致【19】。
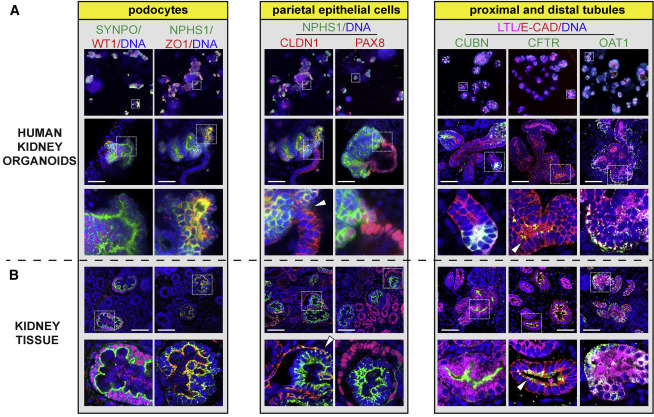
腎類器官與腎組織的biomarkers分佈高度一致【19】
Q39:類器官的的來源細胞必須要具有多能性嗎?正常組織成熟體細胞可以進行類器官培養嗎?
A39:由於類器官涉及到體外分化和自組裝,因此來源細胞必須具有多能性。正常組織的成熟體細胞中往往會有一部分成體幹細胞(標誌物為Lgr5,CD133等),這部分細胞也可以進行類器官培養。
Q40:可以通過構建條件性培養基代替商品化的細胞因數嗎?
A40:依據Hans Clevers實驗室早期發表的文章,可以採用條件性培養基代替純化的細胞因數進行類器官培養,但同時也需要考慮條件性培養基的不足之處。小編總結了條件性培養基和近岸細胞因數的參數差異。
表1. 條件性培養基和Novoprotein細胞因數的參數差異
.png)
總的來說,條件性培養基對於部分預實驗或少量類器官培養是可行的,但鑒於質粒構建和驗證消耗的時間,以及檢測過程涉及的抗體、qPCR等成本也是需要考慮在內的。同時,細胞代謝產物、內毒素和宿主殘留物等也有可能影響實驗結果。因此,選用高品質的商品化細胞因數能夠幫您節約時間和金錢成本,快速推動類器官培養進程。
