類器官培養100問-上篇50問(2)
Novoprotein 2023-06-15 18:42 發表於上海
類器官是能夠在體外三維培養,並表現出相應器官生物學特徵的“最小系統”。雖然對於類器官的研究日趨成熟,但大家總會有這樣那樣的小困惑:為什麼要用上皮細胞培養?為什麼培養基的成分這麼複雜?
Novoprotein憑藉構建類器官平臺的實踐經驗和深厚的文獻積累,圍繞類器官培養基本操作(基礎篇),腫瘤類器官培養(PDO篇),以及類器官應用等多個主題方向,精心整理了類器官培養常見問題100問,今天為大家帶來上篇。
<< 實際操作篇 >>
類器官是能夠在體外三維培養,並表現出相應器官生物學特徵的“最小系統”。雖然許多類器官的培養方案日漸成熟,但在實際操作中總會碰到這樣那樣的問題,今天小編整理了一些類器官培養操作中常遇到的問題,希望能夠對各位小夥伴有所幫助。
Q41: 按照文獻方法進行類器官培養,為什麼觀察到的形態卻和文獻不一致?
A41:決定類器官形態的因素有很多,樣本來源是否相同、選用的細胞因數品質是否有差異都有可能改變最終的類器官形態。這裡舉一個文獻中的例子,分別取四個高級別漿液性(HGS)卵巢癌患者的腫瘤組織,用同樣的條件進行類器官培養,H&E染色結果顯示它們的形態千差萬別【20】。因此對於類器官的鑒定,我們不能局限於形態觀察,需要使用多種方法相結合。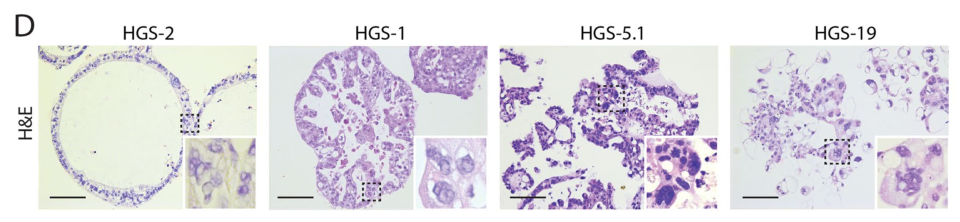
由4例HGS卵巢癌患者的腫瘤組織所製備的類器官形態不同【20】
Q42:類器官的藥敏實驗中需要使用DMSO作為藥物的溶劑,需要控制DMSO的用量嗎?
A42:考慮到DMSO這類有機物的細胞毒性,建議終濃度不超過0.1%(v/v)。
Q43:培養過程中發現類器官培養物中有黑色小顆粒,這個是雜質嗎?應該怎樣去除?
A43:黑色小顆粒大概率是雜質或細胞碎片,去除它們有以下兩種方式可以參考:
1、將類器官消化下來,用培養基進行反復清洗,達到稀釋雜質的作用;
2、用無菌手術刀將類器官切成兩半,取1ml注射器吸滿培養基並輕輕推出,沖洗類器官中的雜質【21】。
Q44:對於腫瘤患者的個性化醫療測試,PDO、PDX、PDXO的模型可以相互結合使用嗎?
A44:PDO、PDX、PDXO模型有各自的優勢,通常有以下兩種結合方式:PDO-PDX和PDX-PDXO。
1、PDO-PDX是性價比更高的方式,即:先利用PDO進行高通量的藥物篩選,篩選出有效的藥物再進行PDX測試。
2、PDX-PDXO是更精准的藥物測試方式,即:先利用PDX產生大量的體內腫瘤,然後將這些腫瘤分離進行PDXO培養,此時可以通過PDX模型,將PDXO的藥敏實驗結果與體內用藥結果一一對應,進而預測人體用藥的結果,實現對患者更精准的用藥指導;並且可以用PDX模型將轉移後的腫瘤分離,同樣進行PDXO培養和用藥,能夠更精確地對轉移灶進行藥物篩選。
Q45:類器官怎麼從基質膠中回收?
A45:1、將類器官放置在冰上,待基質膠融化後離心進行回收,這種方式適用於不需要將類器官結構完全打散的情況;
2、市售的細胞回收液,可以溫和有效地獲得細胞懸液,不會損傷細胞或細胞表面蛋白。
Q46:為什麼用基質膠來培養類器官?可以用其它類型的凝膠替代嗎?
A46:基質膠能夠為類器官提供支撐作用,目前類器官培養用的基質膠來源於小鼠肉瘤的基底膜基質,其中含有約60%層粘連蛋白、30% IV 膠原和8%的巢蛋白,還含有基底膜聚糖、TGF-ß、表皮生長因數、類胰島素生長因數、組織纖溶酶原等1800多種獨特的蛋白質。由於基質膠中各因數的不確定性,並且存在批次間差異,因此目前也有一些聚焦於基質膠替代方案的研究,見下圖【22】。
.png)
基質膠的三種替代方案【22】。(a)去細胞外基質和其他衍生蛋白質,(b)合成水凝膠,以及(c)工程重組蛋白凝膠
Q47:怎樣確定某一種類器官的培養方式更適用於基質膠包埋法還是氣-液交互法呢?
A47:1、根據所類比的器官自身生長情況選擇,例如:皮膚的正常生長是有一面需要接觸空氣,那麼對於皮膚類器官的培養傾向于利用氣-液交互法來培養【23】;2、考慮所培養的類器官模型的應用方向,例如:氣-液交互法培養易於進行病毒感染實驗,因此用於病毒感染實驗的氣道類器官會優先選擇氣-液交互法培養【24】。
Q48:在進行藥敏實驗前,類器官的接種方式是怎樣的呢?
A48:藥物篩選前,通常將類器官吹散後,用含2%-5%基質膠的培養基懸浮,並最終鋪在基質膠包被的孔板中【25-26】。
Q49:在離心回收時,會有很多類器官粘附在離心管壁,有沒有更好的辦法提高回收率?
A49:建議採用水準轉子代替角轉子,可以有效減少類器官掛在離心管壁的情況。
Q50:利用腫瘤類器官模型進行篩選的藥物有什麼局限性嗎?
A50:1、抗體藥物因為需要免疫細胞的參與,因此腫瘤類器官不能篩選抗體類藥物,此類藥物篩選需要構建腫瘤類器官-腫瘤微環境的模型來實現;2、由於腫瘤類器官中沒有對血管進行培養,因此抗血管類的藥物也同樣不能進行篩選。
Novoprotein依靠專業的研發團隊,精心打造類器官驗證平臺,可提供一系列經驗證、高活性、可信任的類器官培養產品,包括經類器官培養驗證的細胞因數及類器官培養基,助您類器官實驗省心高效!
推薦產品-細胞因子
類器官培養基
| Cat. No. | Product Name |
| OCMHC01 | Intestinal Cancer (腸癌)Organoid Culture Medium |
| OCMHC02 | Renal Cancer (腎癌)Organoid Culture Medium |
| OCMHC03 | Brain Glioma (腦膠質瘤)Organoid Culture Medium |
| OCMHC04 | Liver Cancer(肝癌) Organoid Culture Medium |
| OCMHC05 | Lung Cancer(肺癌) Organoid Culture Medium |
| OCMHC06 | Breast Cancer (乳腺癌)Organoid Culture Medium |
| OCMAN01 | Animal Intestinal(動物腸)Organoid Culture Medium |
參考文獻:
【1】He, A. et al. (2020). Cryopreservation of viable human tissues: Renewable resource for viable tissue, cell lines, and organoid development. Biopreservation and Biobanking, 18(3), 222-227.
【2】Lancaster, M. A. et al. (2013). Cerebral organoids model human brain development and microcephaly. Nature, 501(7467), 373-379.
【3】Sheridan, M. A. et al. (2020). Establishment and differentiation of long-term trophoblast organoid cultures from the human placenta. Nature Protocols, 15(10), 3441-3463.
【4】Beshiri, M. L. et al.(2018). A PDX/organoid biobank of advanced prostate cancers captures genomic and phenotypic heterogeneity for disease modeling and therapeutic screening. Clinical Cancer Research, 24(17), 4332-4345.
【5】McCracken, K. W. et al. (2014). Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature, 516(7531), 400-404
【6】Vlachogiannis, G. et al.(2018). Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science, 359(6378), 920-926.
【7】Chen, X. et al.(2021). Phenotype transition of fibroblasts incorporated into patient‐derived oral carcinoma organoids. Oral Diseases.
【8】Ooft, S. N. et al.(2019). Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science translational medicine, 11(513), eaay2574.
【9】Mullins, C. S. et al. (2013). Establishment and characterization of primary glioblastoma cell lines from fresh and frozen material: a detailed comparison. PloS one, 8(8), e71070.
【10】Vogel, T. W. et al.(2005). Proteins and protein pattern differences between glioma cell lines and glioblastoma multiforme. Clinical cancer research, 11(10), 3624-3632.
【11】Wallaschek N. et al. Establishing pure cancer organoid cultures: identification, selection and verification of cancer phenotypes and genotypes[J]. Journal of molecular biology, 2019, 431(15): 2884-2893.
【12】HERPERS, Bram, et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR× LGR5 bispecific antibody with efficacy in epithelial tumors. Nature Cancer, 2022, 1-19.
【13】Jiang, Shengwei, et al.. (2020). An automated organoid platform with inter-organoid homogeneity and inter-patient heterogeneity. Cell Reports Medicine, 1(9), 100161.
【14】WATANABE, Satoshi, et al. Transplantation of intestinal organoids into a mouse model of colitis. Nature Protocols, 2022, 1-25.
【15】Wang, D. et al. (2020). Long-term expansion of pancreatic islet organoids from resident Procr+ progenitors. Cell, 180(6), 1198-1211.
【16】Sampaziotis, F. et al. (2021). Cholangiocyte organoids can repair bile ducts after transplantation in the human liver. Science, 371(6531), 839-846.
【17】Driehuis, E., Kretzschmar, K., & Clevers, H. (2020). Establishment of patient-derived cancer organoids for drug-screening applications. Nature protocols, 15(10), 3380-3409.
【18】Hendriks, D., Clevers, H., & Artegiani, B. (2020). CRISPR-Cas tools and their application in genetic engineering of human stem cells and organoids. Cell Stem Cell, 27(5), 705-731.
【19】Czerniecki, S. M. et al. (2018). High-throughput screening enhances kidney organoid differentiation from human pluripotent stem cells and enables automated multidimensional phenotyping. Cell stem cell, 22(6), 929-940.
【20】Kopper, O. et al. (2019). An organoid platform for ovarian cancer captures intra-and interpatient heterogeneity. Nature medicine, 25(5), 838-849.
【21】MILLER, Alyssa J., et al. Generation of lung organoids from human pluripotent stem cells in vitro. Nature protocols, 2019, 14.2: 518-540.
【22】Kozlowski, M. T. et al. (2021). Towards organoid culture without Matrigel. Communications biology, 4(1), 1-15.
【23】Gangatirkar, P. et al. (2007). Establishment of 3D organotypic cultures using human neonatal epidermal cells. Nature protocols, 2(1), 178-186.
【24】Mulay, A. et al. (2021). SARS-CoV-2 infection of primary human lung epithelium for COVID-19 modeling and drug discovery. Cell reports, 35(5), 109055.
【25】Van de Wetering, M. et al. (2015). Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell, 161(4), 933-945.
【26】Hirt, C. K. et al. (2022). Drug screening and genome editing in human pancreatic cancer organoids identifies drug-gene interactions and candidates for off-label therapy. Cell genomics, 2(2), 100095.
