生物製品宿主核酸去除解決方案
Novoprotein 2023-02-28 19:23 發表於浙江
隨著越來越多的生物製品(重組蛋白疫苗、病毒載體疫苗、細胞治療/基因治療藥物等)進入治療領域,生物製品的質量控制也日趨嚴格,其中核酸殘留因其潛在的危害性,是各類質控標準的重中之重。
中國藥典中明確規定酵母、大腸桿菌表達的生物製品中DNA殘留量不超過10ng/劑量。2020年藥典將人用狂犬病疫苗(Vero細胞)DNA殘留標準更新為≤3ng/劑量。除了殘留量的規定,FDA、CDE發布的相關指導文件中建議,殘留的細胞宿主DNA片段不能超過一個功能基因的長度(約200bp)1,2。
因此,在生物製品的生產工藝中必須有去除核酸殘留的步驟,確保生物製品的中的核酸殘留滿足相應法規的要求。
Novoprotein提供高品質DMF備案GMP級全能核酸酶(BenzoNuclease ®)及高性能配套全能核酸酶殘留檢測試劑盒(檢測範圍0.014-10ng/ml),靈敏度高,為生物製品解決宿主核酸殘留困擾。

全能核酸酶是去除生物製品宿主核酸的利器
在宿主核酸去除工作中,難點是由於DNA帶有大量的電荷易與其他生物大分子結合從而產生聚集(吸附)、包裹作用而難以完全除去。傳統的方法均存在低含量核酸殘留去除不淨、工作量大、耗時長的缺陷。全能核酸酶是一種來自于粘質沙雷氏菌(Serratia marcescens),經基因工程改造的核酸內切酶,可高效降解單鏈、雙鏈、線性、環狀、超螺旋等任何形式的DNA及RNA,完全將核酸降解成3~5個堿基長度的5'-單磷酸寡核苷酸。目前已廣泛應用於病毒載體疫苗、基因與細胞治療等企業的病毒純化工藝中。

生物製品領域空前發展機遇,供應鏈協同需加強
2021年12月30日,國家藥監局等8部門聯合印發《“十四五”國家藥品安全及促進高品質發展規劃》,提出支持藥品、醫療器械、疫苗等領域的創新發展,推動關鍵核心技術攻關,促推解決產業創新發展的“卡脖子”問題,提升產業整體水準。
同日,工信部等9部門聯合印發《“十四五”醫藥工業發展規劃》,提出在疫苗領域,重點發展新型新冠病毒疫苗、皰疹疫苗、多價人乳頭瘤病毒(HPV)疫苗、多聯多價疫苗等產品。在其它領域,重點發展針對新靶點、新適應症的嵌合抗原受體 T 細胞(CAR-T)、嵌合抗原受體 NK 細胞(CAR-NK)等免疫細胞治療、幹細胞治療、基因治療產品和特異性免疫球蛋白等。強調新型疫苗研發和產業化能力建設。緊跟疫苗技術發展趨勢,基於應對新發、突發傳染病需求,支援建設新型病毒載體疫苗、去氧核糖核酸(DNA)疫苗、信使核糖核酸(mRNA)疫苗、疫苗新佐劑和新型遞送系統等技術平臺,推動相關產品的開發和產業化。鼓勵疫苗生產企業開展國際認證,按照國際疫苗採購要求生產、出口疫苗。
《“十四五”醫藥工業發展規劃》鼓勵疫苗生產企業和關鍵原輔料、耗材、設備企業加強協作,針對應急狀態下可能出現的峰值需求,提高供應鏈應急適配能力。提高疫苗供應鏈保障水準。支持疫苗企業和重要原輔料、耗材、生產設備、包裝材料企業協作,提高各類產品品質技術水準。
目前全能核酸酶的應用市場主要還是被國外企業佔據,其價格高、供貨週期長,且受國際貿易政策影響,存在供應中斷風險。因此,生物製品生產企業需要將視線轉向國內同類產品,這也符合目前國產供應鏈建設的大趨勢。
Novoprotein全能核酸酶質優價廉
Novoprotein提供GMP條件下生產的全能核酸酶BenzoNuclease®,無動物源性, 無氨苄青黴素,可高效降解單鏈、雙鏈、線性、環狀、超螺旋等任何形式的DNA及RNA。品質、性能、供貨能力可靠,並已完成在FDA的藥物主文件(Drug Master File, DMF)申報備案,滿足藥物申報的規範。

Novoprotein全能核酸酶嚴格的品質控制及生產標準
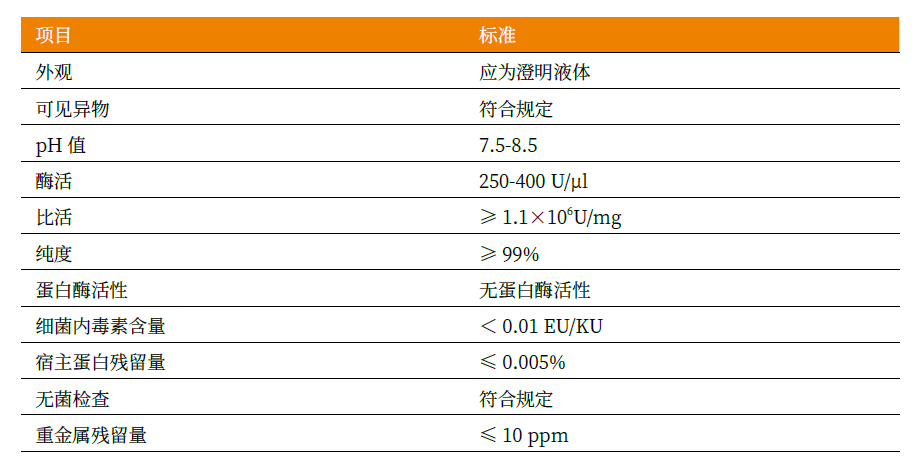
Novoprotein全能核酸酶寬泛的反應條件
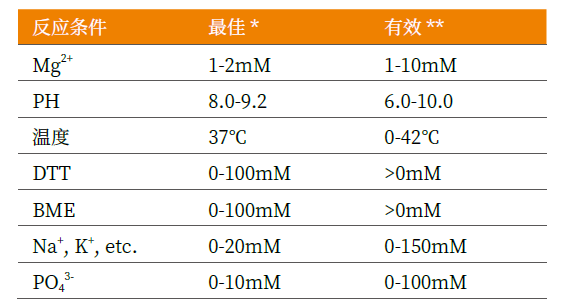
Novoprotein全能核酸酶性能優異
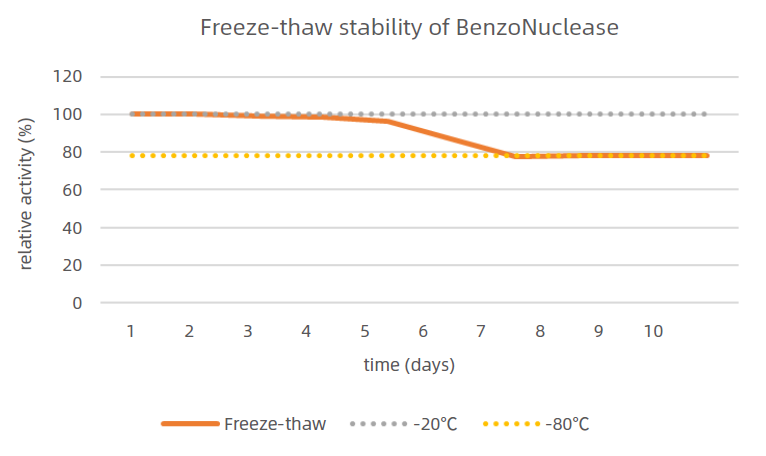
1、保存穩定性以及凍融穩定性
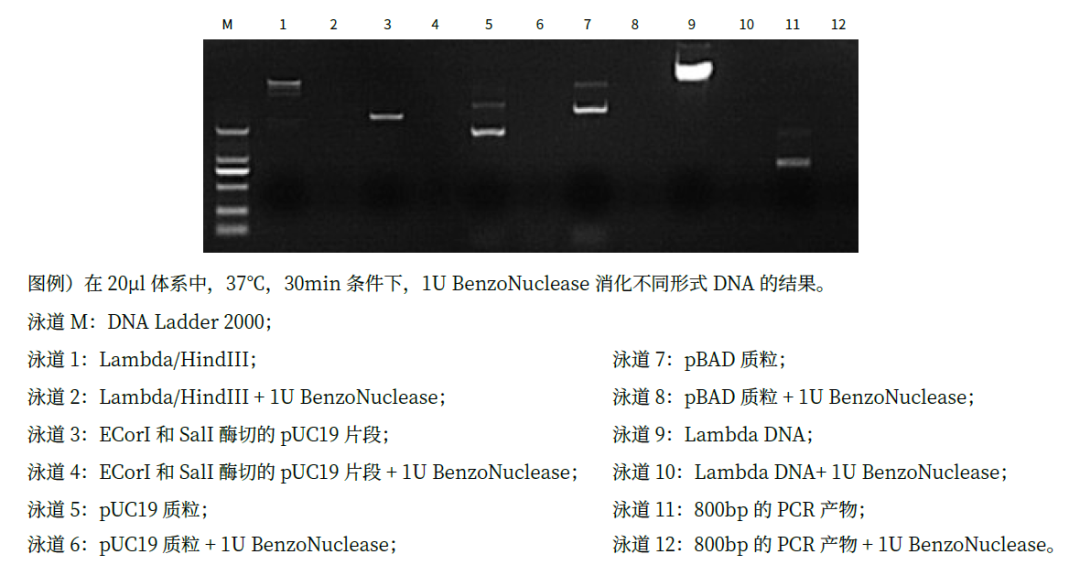
2、消化不同類型核酸
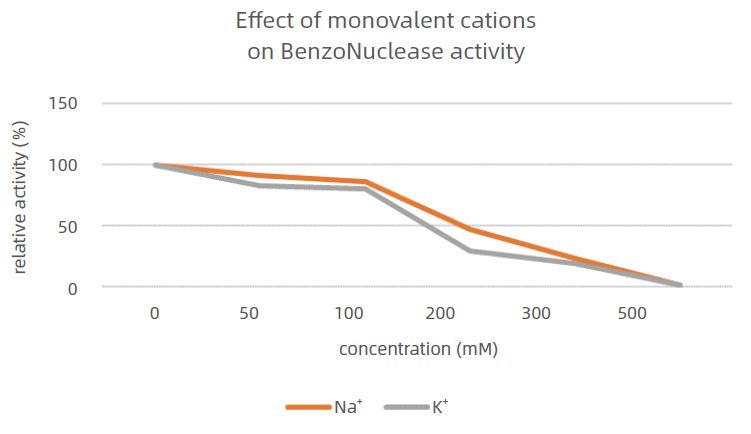
3、鈉離子、鉀離子的影響
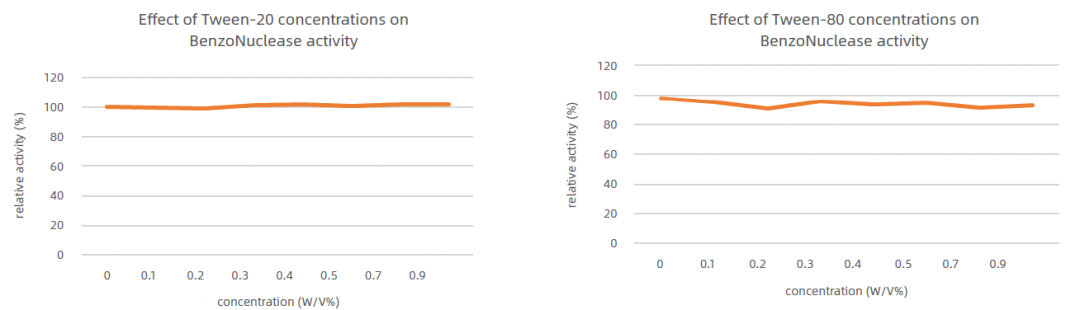
4、Tween-20、Tween-80的影響
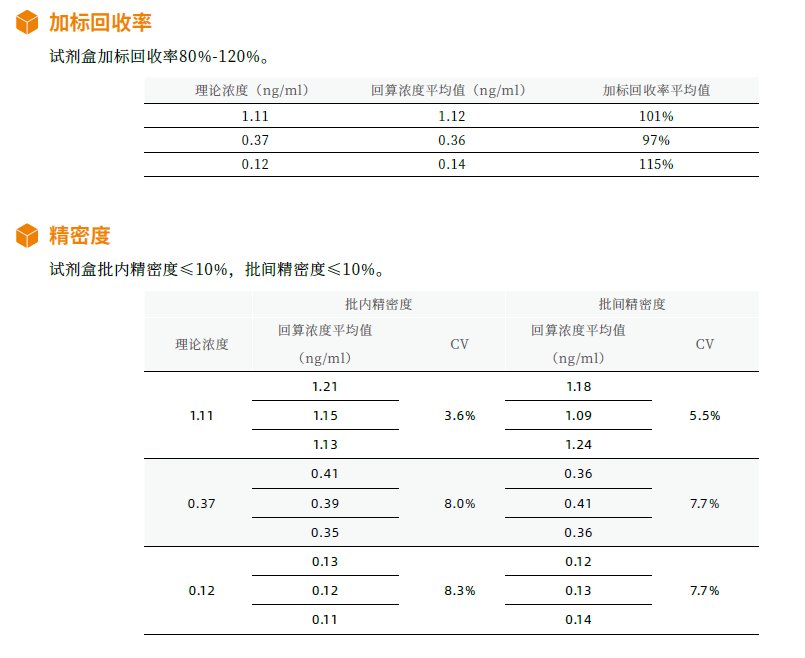
Novoprotein全能核酸酶殘留檢測試劑盒性能脫穎而出
在使用核酸酶處理過的生物製品中,可能存在微量的核酸酶殘留,這些微量殘留會對後續生物製品的應用造成一定的影響。生物製品中核酸酶的殘留量也是衡量生物製品品質的重要指標之一。
Novoprotein開發的核酸酶殘留檢測試劑盒可以高靈敏度(0.014ng/ml)、檢測範圍0.014-10.00ng/ml, 特異性地檢測和定量分析樣品中的全能核酸酶殘留。
| Cat# | Product Name | Spec |
| GMP-1707 | BenzoNuclease®, GMP Grade | 100KU/200KU/5000KU |
| PA018 | BenzoNuclease® ELISA Kit | 96T |
Q&A
1. 在哪一步中加入 BenzoNuclease®?
BenzoNuclease®可直接加入至細胞/細菌裂解液中進行作用。注意,若裂解液中不含Mg2+,需補加Mg2+至1-2mM。
2. 當反應溫度低於 37℃時,如何保證BenzoNuclease®的消化效果?
在體系固定的情況下,BenzoNuclease®的消化效果主要取決於酶用量、反應溫度以及反應時間,當反應溫度較低時,為避免過多的BenzoNuclease®引起的殘留問題,更加推薦延長反應時間來保證BenzoNuclease®的消化效果。
3. BenzoNuclease®的抑制條件有哪些?
BenzoNuclease®可在較為寬泛的條件下保持活性,但1-2mM Mg2+對其活性至關重要。
一般情況下,BenzoNuclease®的活性可被高鹽抑制,例如:>500mM的一價陽離子(如 Na+、K+等)、>100mM的鹽酸胍(guanidine HCl)、> 100mM的磷酸鹽(phosphate)、> 100mM的硫酸銨(ammonium sulfate)等。此外,螯合劑也可通過螯合體系中的Mg2+以達到抑制酶活的作用,通過加入更多的Mg2+可恢復BenzoNuclease®的活性(1mM的EDTA 可部分抑制BenzoNuclease®活性,5mM的EDTA可使其活性喪失約90%。
4. BenzoNuclease®與蛋白酶抑制劑可以相容嗎?
可以。但需要注意,最好選擇不含EDTA的蛋白酶抑制劑(≥1mM的EDTA可抑制 BenzoNuclease®的活性)。
5. 如何去除BenzoNuclease®?
BenzoNuclease®融合了6×His標籤,可通過鎳柱將其去除。此外,也可結合所生產產品本身的純化工藝對BenzoNuclease®進行去除,如通過TFF(tangential flow filtration)、透析及色譜(IEX, SEC, HIC)、超濾等。
6. BenzoNuclease®的應用是否有專利限制?
無專利限制。
7. 料液經過BenzoNuclease®處理後的核酸殘留使用什麼方法檢測比較好?
推薦使用qPCR進行檢測,qPCR方法的靈敏度和重複性較好,並且可定量,可以對核酸殘留有更加準確的把握。
8. GMP-1707的儲存液中含有2mM MgCl2,加到樣品中之後,需要補加Mg2+嗎?
如果樣品溶液中不含Mg2+或者Mg2+濃度較低,建議補加Mg2+至全能核酸酶的最佳工作濃度(1-2mM)。
參考文件:
1、 FDA《用於生產和傳染病適應症的病毒疫苗的細胞基質和其他生物材料的特性和鑒定》;
2、 CDE《基因治療產品藥學研究與評價技術指導原則》。
