生物製品宿主核酸殘留控制的利器-全能核酸酶及其高敏檢測試劑盒
Novoprotein 2023-06-26 18:48 發表於浙江
隨著越來越多的生物製品(重組蛋白疫苗、病毒載體疫苗、細胞治療/基因治療藥物等)進入治療領域,生物製品的質量控制也日趨嚴格,其中核酸殘留因其潛在的危害性,是各類質控標準的重中之重。
中國藥典中明確規定酵母、大腸桿菌表達的生物製品中DNA殘留量不超過10ng/劑量。2020年藥典將人用狂犬病疫苗(Vero細胞)DNA殘留標準更新為≤3ng/劑量。除了殘留量的規定,FDA、CDE發布的相關指導文件中建議,殘留的細胞宿主DNA片段不能超過一個功能基因的長度(約200bp)1,2。
因此,在生物製品的生產工藝中必須有去除核酸殘留的步驟,確保生物製品的中的核酸殘留滿足相應法規的要求。
全能核酸酶是去除生物製品宿主核酸的利器
在宿主核酸去除工作中,難點是由於DNA帶有大量的電荷易與其他生物大分子結合從而產生聚集(吸附)、包裹作用而難以完全除去。傳統的方法均存在低含量核酸殘留去除不淨、工作量大、耗時長的缺陷。全能核酸酶是一種來自于粘質沙雷氏菌(Serratia marcescens),經基因工程改造的核酸內切酶,可高效降解單鏈、雙鏈、線性、環狀、超螺旋等任何形式的DNA及RNA,完全將核酸降解成3~5個堿基長度的5'-單磷酸寡核苷酸。目前已廣泛應用於病毒載體疫苗、基因與細胞治療等企業的病毒純化工藝中。

Novoprotein提供高品質DMF備案GMP級全能核酸酶(BenzoNuclease ®)及高性能配套全能核酸酶殘留檢測試劑盒(檢測範圍0.014-10ng/ml),靈敏度高,為生物製品解決宿主核酸殘留困擾。

生物製品領域空前發展機遇,供應鏈協同需加強
2021年12月30日,國家藥監局等8部門聯合印發《“十四五”國家藥品安全及促進高品質發展規劃》,提出支持藥品、醫療器械、疫苗等領域的創新發展,推動關鍵核心技術攻關,促推解決產業創新發展的“卡脖子”問題,提升產業整體水準。
同日,工信部等9部門聯合印發《“十四五”醫藥工業發展規劃》,提出在疫苗領域,重點發展新型新冠病毒疫苗、皰疹疫苗、多價人乳頭瘤病毒(HPV)疫苗、多聯多價疫苗等產品。在其它領域,重點發展針對新靶點、新適應症的嵌合抗原受體 T 細胞(CAR-T)、嵌合抗原受體 NK 細胞(CAR-NK)等免疫細胞治療、幹細胞治療、基因治療產品和特異性免疫球蛋白等。強調新型疫苗研發和產業化能力建設。緊跟疫苗技術發展趨勢,基於應對新發、突發傳染病需求,支援建設新型病毒載體疫苗、去氧核糖核酸(DNA)疫苗、信使核糖核酸(mRNA)疫苗、疫苗新佐劑和新型遞送系統等技術平臺,推動相關產品的開發和產業化。鼓勵疫苗生產企業開展國際認證,按照國際疫苗採購要求生產、出口疫苗。
《“十四五”醫藥工業發展規劃》鼓勵疫苗生產企業和關鍵原輔料、耗材、設備企業加強協作,針對應急狀態下可能出現的峰值需求,提高供應鏈應急適配能力。提高疫苗供應鏈保障水準。支持疫苗企業和重要原輔料、耗材、生產設備、包裝材料企業協作,提高各類產品品質技術水準。
BenzoNuclease ®的應用
1. 病毒純化:在病毒疫苗、病毒載體疫苗、細胞和基因治療產品以及溶瘤病毒的生產工藝中涉及病毒培養和純化,使用BenzoNuclease ®可去除宿主細胞裂解釋放病毒的同時釋放出來的宿主核酸,降低核酸殘留毒性風險,提高產品安全性。
全能核酸酶在病毒純化中最常見的使用濃度是25-50U/ml,可以選擇在收穫病毒時、澄清後或純化後用BenzoNuclease ®處理樣品,一般選擇在收穫病毒時或澄清後加入BenzoNuclease ®,可以提高病毒得率。酶的最適溫度是37℃,處理時間從15min-4h不等,隨著反應溫度的降低需要適當延長酶的作用時間。
文獻應用實例:
重組腺相關病毒(rAAVs)純化:向細胞裂解液中加入終濃度為50U/ml的全能核酸酶,37℃孵育30min [3]。
慢病毒(Lentivirus)純化:向收穫的慢病毒料液中加入15–50U/ml全能核酸酶,37℃孵育15-30min [4]。
狂犬病病毒純化:使用全能核酸酶對狂犬病疫苗中Vero細胞DNA進行去除,全能核酸酶終濃度為50-90U/ml,37℃孵育2-3h後,轉入18-26 ℃孵育12-18h,再經分子篩層析純化後,狂犬病病毒收穫液中的Vero細胞DNA去除率在80%以上,病毒抗原回收率在75%以上[5]。
2. 蛋白純化:在重組蛋白或天然蛋白的生產工藝中,第一步就是對細胞/菌體進行裂解釋放蛋白,此時細胞/菌體的基因組DNA也同時被釋放出來,導致提取物非常粘稠,顯著影響蛋白純化的效果和得率。若在裂解細胞/菌體的同時加入一定量的BenzoNuclease ®,可以高效清除粗提物中的核酸,有效降低粘度,提高後續操作的效率和得率。
3. 生物分析實驗樣品的製備,在ELISA、色譜、二維電泳和Western Blot的樣品製備時,使用BenzoNuclease ®處理可提高分辨率和回收率。\
4. 防止細胞結團:近年來,冷凍保存的外周血單核細胞(PBMC) 在免疫分析中的應用急劇增加,PBMC細胞最大的特性是在復蘇後極易結團,容易導致細胞質量低,檢測結果不可信。在細胞復甦的時候將BenzoNuclease ®加入到培養基中和細胞共培養,可以有效防止細胞結團。
Novoprotein全能核酸酶嚴格的品質控制及生產標準
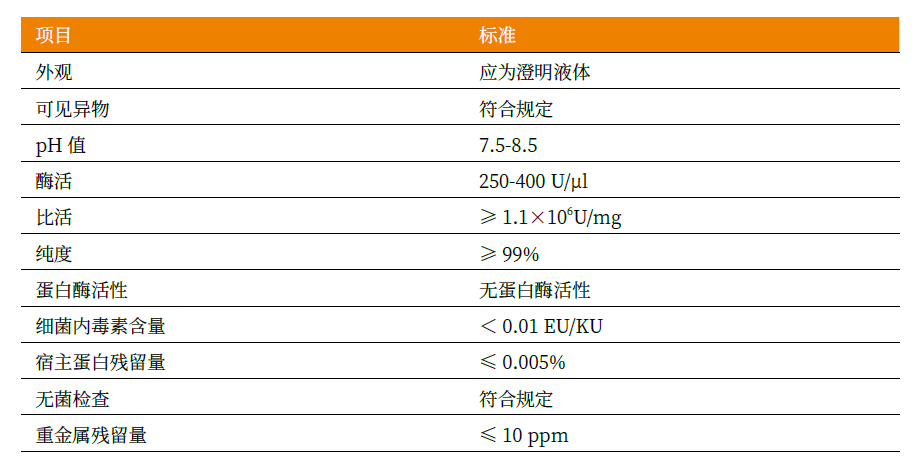
Novoprotein全能核酸酶寬泛的反應條件
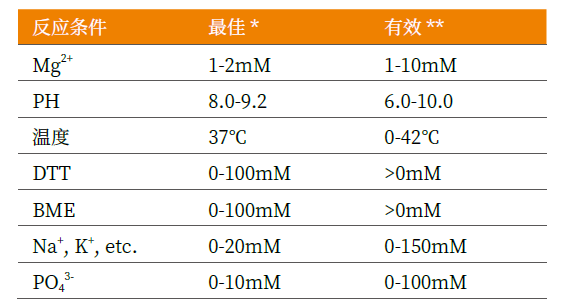
Novoprotein全能核酸酶性能優異
1、保存穩定性以及凍融穩定性
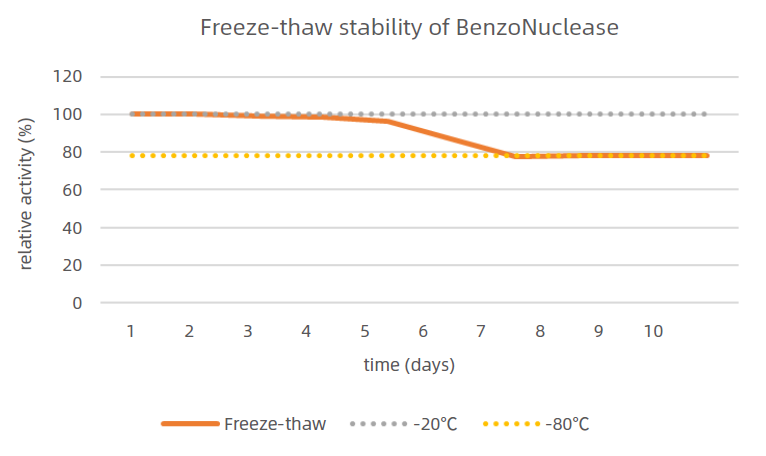
2、消化不同類型核酸
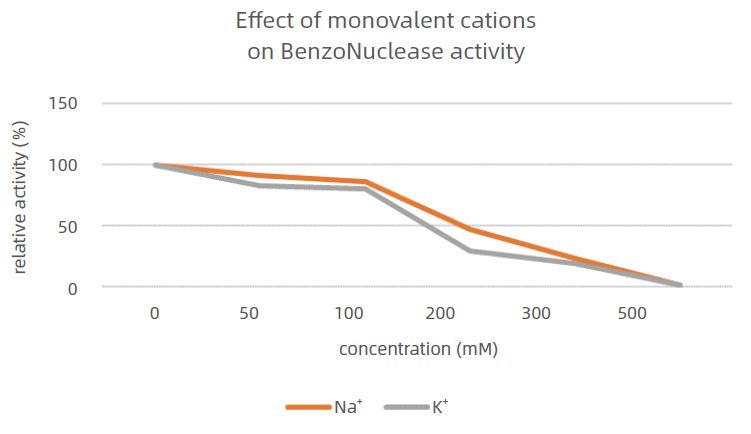
3、鈉離子、鉀離子的影響
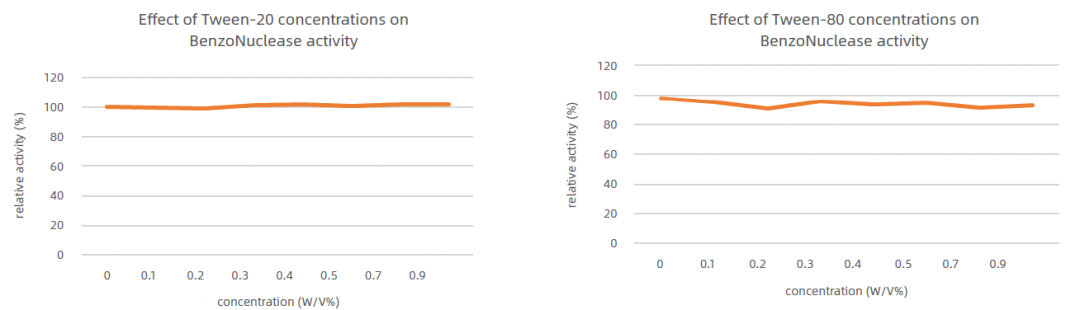
4、Tween-20、Tween-80的影響
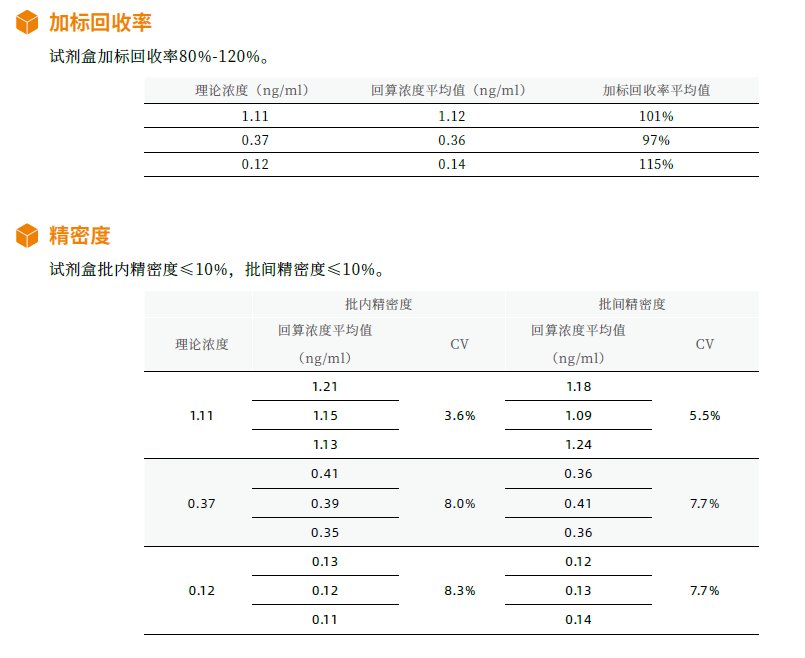
Novoprotein全能核酸酶殘留檢測試劑盒性能脫穎而出
在使用核酸酶處理過的生物製品中,可能存在微量的核酸酶殘留,這些微量殘留會對後續生物製品的應用造成一定的影響。生物製品中核酸酶的殘留量也是衡量生物製品品質的重要指標之一。
Novoprotein開發的核酸酶殘留檢測試劑盒可以高靈敏度(0.014ng/ml)、檢測範圍0.014-10.00ng/ml, 特異性地檢測和定量分析樣品中的全能核酸酶殘留。
| Cat# | Product Name | Spec |
| GMP-1707 | BenzoNuclease®, GMP Grade | 100KU/200KU/5000KU |
| PA018 | BenzoNuclease® ELISA Kit | 96T |
Q&A
1. 在哪一步中加入 BenzoNuclease®?
BenzoNuclease®可直接加入至細胞/細菌裂解液中進行作用。注意,若裂解液中不含Mg2+,需補加Mg2+至1-2mM。
2. 當反應溫度低於 37℃時,如何保證BenzoNuclease®的消化效果?
在體系固定的情況下,BenzoNuclease®的消化效果主要取決於酶用量、反應溫度以及反應時間,當反應溫度較低時,為避免過多的BenzoNuclease®引起的殘留問題,更加推薦延長反應時間來保證BenzoNuclease®的消化效果。
3. BenzoNuclease®的抑制條件有哪些?
BenzoNuclease®可在較為寬泛的條件下保持活性,但1-2mM Mg2+對其活性至關重要。
一般情況下,BenzoNuclease®的活性可被高鹽抑制,例如:>500mM的一價陽離子(如 Na+、K+等)、>100mM的鹽酸胍(guanidine HCl)、> 100mM的磷酸鹽(phosphate)、> 100mM的硫酸銨(ammonium sulfate)等。此外,螯合劑也可通過螯合體系中的Mg2+以達到抑制酶活的作用,通過加入更多的Mg2+可恢復BenzoNuclease®的活性(1mM的EDTA 可部分抑制BenzoNuclease®活性,5mM的EDTA可使其活性喪失約90%。
4. BenzoNuclease®與蛋白酶抑制劑可以相容嗎?
可以。但需要注意,最好選擇不含EDTA的蛋白酶抑制劑(≥1mM的EDTA可抑制 BenzoNuclease®的活性)。
5. 如何去除BenzoNuclease®?
BenzoNuclease®融合了6×His標籤,可通過鎳柱將其去除。此外,也可結合所生產產品本身的純化工藝對BenzoNuclease®進行去除,如通過TFF(tangential flow filtration)、透析及色譜(IEX, SEC, HIC)、超濾等。
6. BenzoNuclease®的應用是否有專利限制?
無專利限制。
7. 料液經過BenzoNuclease®處理後的核酸殘留使用什麼方法檢測比較好?
推薦使用qPCR進行檢測,qPCR方法的靈敏度和重複性較好,並且可定量,可以對核酸殘留有更加準確的把握。
8. GMP-1707的儲存液中含有2mM MgCl2,加到樣品中之後,需要補加Mg2+嗎?
如果樣品溶液中不含Mg2+或者Mg2+濃度較低,建議補加Mg2+至全能核酸酶的最佳工作濃度(1-2mM)。
參考文件:
[1] FDA《用於生產和傳染病適應症的病毒疫苗的細胞基質和其他生物材料的特性和鑑定》;
[2] CDE《基因治療產品藥學研究與評價技術指導原則》。
[3] Miguel SE , Guangping G .Purification of Recombinant Adeno-Associated Viruses (rAAVs) by Iodixanol Gradient Centrifugation[J].Cold Spring Harbor protocols, 2020, 2020年2020卷2期:095612頁.DOI:10.1101/pdb. prot095612.
[4] Sastry L, Xu Y, Cooper R, et al. Evaluation of plasmid DNA removal from lentiviral vectors by benzonase treatment. [J]. Human Gene Therapy, 2004, 15(2):221-6.
[5] 崔燕平.非限制性核酸內切酶對狂犬病疫苗中Vero細胞DNA的去除作用[J].中國生物製品學雜誌, 2014, 27(4):4.DOI:10.13200/j.cnki.cjb .000240.
