解密心臟發育,開啟ipsc誘導類器官探索之旅的第一步
Novoprotein 2023-11-15 19:40 發表於浙江
心臟類器官是一種可呈現心臟組織形狀或功能的體外三維結構,其在一定程度上能模擬心臟發育過程,從而為揭示心臟發育、研究心血管疾病、藥物測試和移植提供了一個強有力工具。成功建立穩定可靠的心臟類器官模型有兩個關鍵因素,一是需要了解體內心臟器官的發育過程,了解其發育的關鍵通路,從而為幹細胞定向誘導分化為心臟類器官提供指導;二則是需要選擇可靠的調節訊號路徑的活性分子(細胞激素和小分子),從而快速且準確的獲得相應的細胞類型。近岸蛋白可提供經類器官培養驗證的細胞因子,為您的類器官培養保駕護航!
人類心臟是發育過程中第一個形成的功能性器官,也是最難在體外建構模型的器官之一[1] 。心肌細胞是心臟中最常見的細胞,在心室中的比例高於心房[2] 。成人心臟心室區包括心尖和室間隔,心肌細胞佔49.2%,血管平滑肌細胞佔21.2%,纖維母細胞佔15.5%,心內膜細胞佔7.8%,免疫細胞佔5.3% [2, 3] 。Wnt/β-catenin訊號在胚胎髮生過程中調控心臟發育,包括心臟中胚層規範、心肌分化和增殖。Wnt訊號能夠調控中胚層心臟祖細胞(Cardiac progenitor cells,CPCs)的擴增與分化狀態[4-9] ,在小鼠胚胎幹細胞分化(mESCs)過程中,胚狀體形成後Wnt/β-catenin訊號的活化抑制心肌分化,同時促進內皮細胞和造血細胞的分化[8] 。在脊椎動物胚胎發育過程中,Wnt訊號的活化誘導胚胎幹細胞進入前後側板中胚層(Lateral plate mesoderm,LPM)。在前LPM中,從內胚層分泌的Wnt抑制因子Dkk阻止Wnt與其受體結合,誘導形成心源性中胚層和CPCs。在LPM中,來自神經管的Wnt訊號指示後中胚層成為血管生成的中胚層,BMPs和Wnt訊號共同作用,促進血管生成中胚層向血液和血管的分化[ 7, 10-12] 。
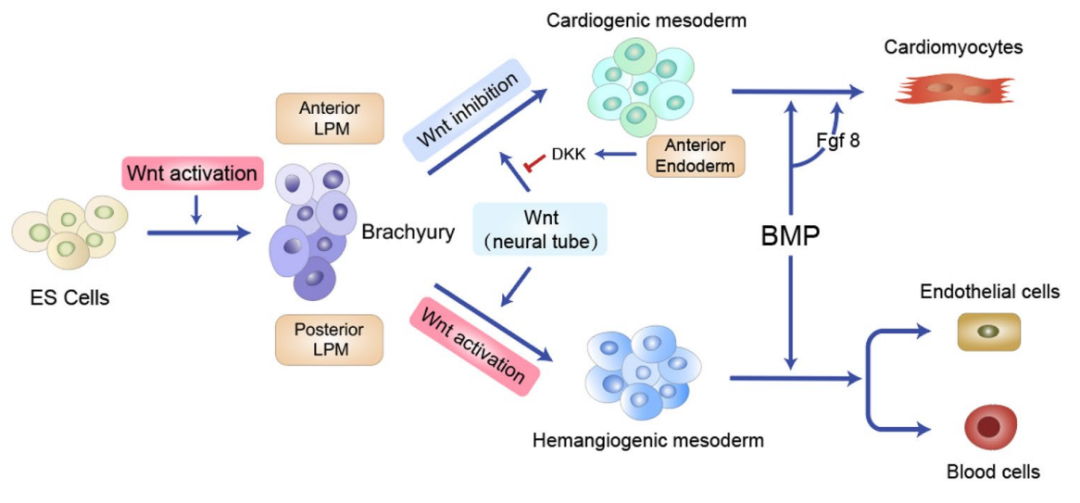
Fig 1 Wnt/β-catenin訊號在心臟發生中的雙相作用
體內和體外研究都表明,在心肌分化過程中,Wnt訊號的作用在促進和限制心肌細胞形成之間搖擺。在人類胚胎幹細胞(hESCs)中,Wnt3和Wnt8a透過FZD7調控Brachyury的表達和誘導心臟中胚層。隨後,Wnt5a/5b透過酪胺酸-蛋白激酶跨膜受體(Tyrosine-protein kinase transmembrane receptor,ROR2)調控MESP1的表達和CPCs的專一性。在hESC發育後期,Wnt2、Wnt5a/5b和Wnt11透過FZD4和FZD6活化非經典Wnt訊號調節心肌細胞分化[13] 。在人類誘導多能幹細胞(hiPSC)中,若在分化初期敲低β-catenin,可完全阻斷心臟中胚層的形成,而抑制GSK-3β可促進CPCs的形成[14] 。
從動物和細胞模型的研究中,我們已經知道心臟譜係是如何從胚胎中胚層開始以特定的方式產生心肌細胞、心內膜細胞和心外膜細胞等心臟細胞類型[15-17],接下來則需要明確訊號如何引導這些細胞類型自組織成層並形成心臟腔。源自人類多能幹細胞的心臟形成類器官(Heart forming organoids,HFOs)是一種複雜的、高度結構化的早期心臟、前腸和脈管系統發育的體外模型,該模型成為了體外心臟研究中強大的工具,包括致畸性探究,基因功能分析和藥物篩選,可以幫助我們探索心臟的發育模式。在體內,心內膜細胞首先形成心內膜管,然後透過充滿細胞外基質的間隙與外心肌細胞管分離,最後形成心腔的內層[14],但訊號如何規範並協調這些模式和形態發生過程尚不清楚。研究人員透過來自人類多能幹細胞的自組織心臟類器官發現,中胚層誘導過程中較高劑量的Wnt訊號會在心臟中胚層後期引起腔擴張,且高到一定程度後會促進非心肌細胞特異性的空腔。中等劑量的Wnt促進了空腔形態的形成和心肌細胞的特異性。BMP在多個階段驅動心臟特異性發育,在心臟中胚層階段的最初階段使用Noggin或化合物LDN193189阻斷BMP訊號導致腔體形態受損,心臟中胚層密度增加,類心細胞縮小但數量保持穩定。中胚層WNT-BMP訊號軸控制兩個關鍵的自組織過程,即:自我模式發生和自我形態發生[18]。在心臟中胚層階段,較低的Wnt訊號活化導致VEGF-A和其他心內膜細胞特異性因子(ETV2,TAL1,LMO2和PECAM1)的上調。同時scRNA-seq分析顯示,與中度Wnt/高Activin誘導的心臟相比,低Wnt/低Activin誘導的心室樣心臟表達VEGF-A的心肌細胞比例較高。在中胚層誘導過程中,最佳訊號劑量的Wnt和Activin可以控制後期心內膜的自組織,從而形成心腔的部分內層;相較之下,在較高Wnt和Activin劑量的條件下則觀察不到心內膜細胞的自組織。VEGF刺激了心肌細胞層和心內膜細胞層的早期分離,這是胚胎心臟中胚層和心管階段的一個重要環節。然而,外源性VEGF不足以控制心內膜細胞在內膜的正確內外取向。因此,Wnt/Activin的劑量和VEGF訊號調節的時間共同調節了心臟空腔形態的形成以及心肌細胞和心內膜細胞譜系的體內正確模式[18]。
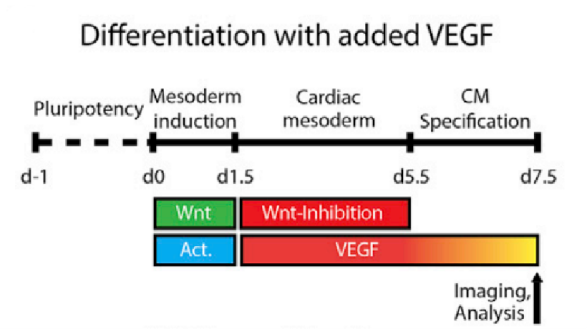
Fig 2 Wnt、Activin和VEGF協調內皮細胞和心肌細胞的自組織
心血管疾病是世界各地致人死亡的主要疾病之一,在人類心臟研究中,科學家傾向於利用人類多能幹細胞衍生心臟譜系細胞的自組織特性來建構心臟類器官模型,目前已在體外通過不同的細胞來源、生長基質和誘導方式建構了不同發育程度的人類心臟類器官[18-21](近岸類器官課堂-心靈捕手),利用不同生長階段的類器官模型,我們可以更了解心臟在體內的發育方式,同時也為心血管疾病藥物的研發提供了更精準的體外模型。
Novoprotein可提供自主研發生產並經過類器官培養驗證的低內毒素Activin A、BMP-4、EGF、FGF-7、FGF-10、FGFb、FGF8b、HGF、IGF1、Noggin、NRG1、R-Spondin 1/3和Wnt3a等細胞因子,這些細胞因子已經在人類腫瘤類器官如腦下垂體瘤類器官、腦膜瘤類器官、乳癌類器官,人類正常類器官如ipsc來源的人小腸類器官,以及小鼠正常類器官如小腸、結腸、胃、膽管以及氣道類器官等體外模型上進行了驗證。
| Cat. No. | Product Name |
| C687 | Human/Mouse/Rat Activin A |
| C779 | Human FGF basic/FGF-2/bFGF |
| C044 | Mouse FGF basic/FGF-2/bFGF |
| C012 | Human/Mouse/Rat BMP-2 |
| CR93 | Recombinant Human BMP-4 |
| C28B | Recombinant Human BMP-7 |
| CB89 | Recombinant Human Noggin |
| C744 | Recombinant Human VEGF121 |
| C083 | Recombinant Human VEGF165 |
| C22R | Recombinant Human Wnt3a V3 |
參考文獻
[1]Schutgens F, Clevers H. Human Organoids: Tools for Understanding Biology and Treating Diseases[J]. Annu Rev Pathol, 2020, 15: 211-234.
[2] Litviňuková M, Talavera-López C, Maatz H, et al. Cells of the adult human heart[J]. 2020, 588(7838): 466-472.
[3] Chen L, Hua K, Zhang N, et al. Multifaceted Spatial and Functional Zonation of Cardiac Cells in Adult Human Heart[J]. 2022, 145(4): 315-318.
[4] Gessert S, Kühl M. The multiple phases and faces of wnt signaling during cardiac differentiation and development[J]. Circ Res, 2010, 107(2): 186-199.
[5] Noseda M, Peterkin T, Simões FC, et al. Cardiopoietic factors: extracellular signals for cardiac lineage commitment[J]. Circ Res, 2011, 108(1): 129-152.
[6] Qyang Y, Martin-Puig S, Chiravuri M, et al. The renewal and differentiation of Isl1+ cardiovascular progenitors are controlled by a Wnt/beta-catenin pathway[J]. Cell Stem Cell, 2007, 1(2): 165-179.
[7] Schneider VA, Mercola M. Wnt antagonism initiates cardiogenesis in Xenopus laevis[J]. Genes Dev, 2001, 15(3): 304-315.
[8] Naito AT, Shiojima I, Akazawa H, et al. Developmental stage-specific biphasic roles of Wnt/beta-catenin signaling in cardiomyogenesis and hematopoiesis[J]. Proc Natl Acad Sci USA, 2006, 103(52): 19812): 19812) -19817.
[9] Ueno S, Weidinger G, Osugi T, et al. Biphasic role for Wnt/beta-catenin signaling in cardiac specification in zebrafish and embryonic stem cells[J]. Proc Natl Acad Sci USA, 2007, 104(23): 9685-9690.
[10] Tzahor E, Lassar A B. Wnt signals from the neural tube block ectopic cardiogenesis[J]. Genes Dev, 2001, 15(3): 255-260.
[11] Marvin MJ, Di Rocco G, Gardiner A, et al. Inhibition of Wnt activity induces heart formation from posterior mesoderm[J]. Genes Dev, 2001, 15(3): 316-327.
[12] Olson E N. Development. The path to the heart and the road not taken[J]. Science, 2001, 291(5512): 2327-2328.
[13] Mazzotta S, Neves C, Bonner RJ, et al. Distinctive Roles of Canonical and Noncanonical Wnt Signaling in Human Embryonic Cardiomyocyte Development[J]. Stem Cell Reports, 2016, 7(4): 764-776.
[14] Lian X, Hsiao C, Wilson G, et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling[J]. Proc Natl Acad Sci USA, 2012, 109(aling[J]. Proc Natl Acad Sci USA, 2012, 109(1827) E1848-1858 .
[15] Lee JH, Protze SI, Laksman Z, et al. Human Pluripotent Stem Cell-Derived Atrial and Ventricular Cardiomyocytes Develop from Distinct Mesoderm Populations[J]. Cell Stem Cell, 2017, 21(2): 179-194. Cell Stem Cell, 2017, 21(2): 179-194. .
[16] Mendjan S, Mascetti VL, Ortmann D, et al. NANOG and CDX2 pattern distinct subtypes of human mesoderm during exit from pluripotency[J]. Cell Stem Cell, 2014, 15(3): 310-325.
[17] Birket MJ, Ribeiro M C. Expansion and patterning of cardiovascular progenitors derived from human pluripotent stem cells[J]. Nat Biotechnol, 2015, 33(9): 970-979.
[18] Hofbauer P, Jahnel SM, Papai N, et al. Cardioids reveal self-organizing principles of human cardiogenesis[J]. Cell, 2021, 184(12): 3299-3317.e3222.
[19] Drakhlis L, Devadas SB, Zweigerdt R. Generation of heart-forming organoids from human pluripotent stem cells[J]. Nat Protoc, 2021, 16(12): 5652-5672.
[20] Zhao D, Lei W, Hu S. Cardiac organoid - a promising perspective of preclinical model[J]. Stem Cell Res Ther, 2021, 12(1): 272.
[21] Drakhlis L, Biswanath S, Farr CM, et al. Human heart-forming organoids recapitulate early heart and foregut development[J]. Nat Biotechnol, 2021, 39(6): 737-746.
