類器官替代動物實驗?有哪些機會與挑戰
Novoprotein 2023-01-19 19:12 發表於浙江
近日,臨床,《Science》期刊發布重磅消息,針對新藥或仿製藥的試驗,FDA不再強制要求提供動物試驗相關測試數據(點擊了解詳情)。
2022年9月,美國參議院無異議地一致通過了美國食品藥物管理局現代化法案(FDA現代化法案2.0),該法案不再強制聯邦對新藥和仿製藥進行動物試驗的要求,旨在未來幾年該法案完全禁止動物試驗,但它允許藥物使用替代方法來研究新藥的安全性和有效性。
替代方法人群,類器官“初露頭角”
早在2022年8月,美國FDA首次完全基於在人體器官晶片研究中獲得的臨床治療前數據,結合現有的安全性數據,批准了一項在研治療進入臨床試驗。這項批准並未使用傳統動物實驗提供的測試數據。這項決定充分體現了FDA對類器官研究可信度的認可。
什麼是類器官?
類器官是在體外由成體幹細胞(ASCs)形成胎兒能幹細胞(PSCs)製備的器官。它們透過幹細胞的微小自組織、自我更新和吸取能力為三維(3D)組織樣結構。與傳統的二維( 2D)培養細胞或球體相比,類器官在解剖學上和功能上接近活體器官,它們可以由正常組織和發炎組織建構。
類器官具備的特徵:
(1)必須包含一種以上與來源器官相同的細胞類型
(2)應該表現出器官所特有的一些功能
(3)細胞的組織方式應與來源器官相似
類器官模型
針對不同的疾病研究,目前最常用的生物模式是花生酵母,C.elegans(秀麗隱桿線蟲),D.melanogaster(黑腹果蠅),斑馬魚和常規突變體。此外,對於癌症研究,也使用了患者來源的異種移植物(PDX)和殭屍系。殭屍係有其獨特的優點和限制。 與傳統的二維培養模型相比,類器官可以代表整個生物體的生理過程,具有更接近國內細胞組成和行為,基因組更穩定,更適合生物轉染和高通量篩選的優點。與動物模型相比,類器官模型的操作不僅更簡單,而且還可以用於研究疾病的發生和發展的機制。
 X
X
類器官培養體系
2009年Sato等分離小鼠小腸上皮隱窩,採用獨特的無血清環境培養,以支撐膜基質,EGF,Noggin,R-Spondin蛋白為環境因子,建立了小鼠小腸類器官3D培養系統[2 ],此培養體系獲得的破壞類器官可保持其隱窩來源的特性,很容易在短週期內獲得,並可長期保存。該培養體系獲得的破壞類器官的成功開啟了類器官研究的新篇章。
產品特點:
(1)高純度、高活性、低內毒素(<10EU/mg)、高批間一致性
(2)產品種類全(30餘種,涵蓋人類及小鼠),滿足不同類器官培養需求
(3)現貨供應(多種包裝規格任意選擇)
產品驗證數據:
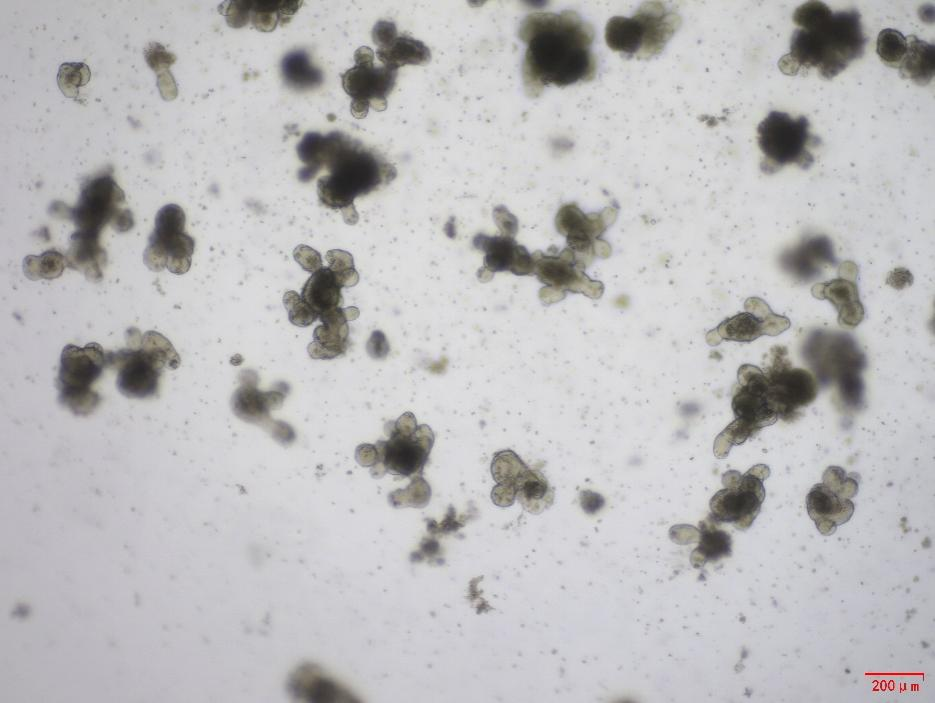
小鼠腸道類器官與 EGF (Cat#C029)、Wnt3a (Cat#C22R)、Noggin (Cat#C028) 和 R-spondin 1 (Cat#CX83) 一起培養。培養五天后,類器官表現出良好的形態和發芽率。
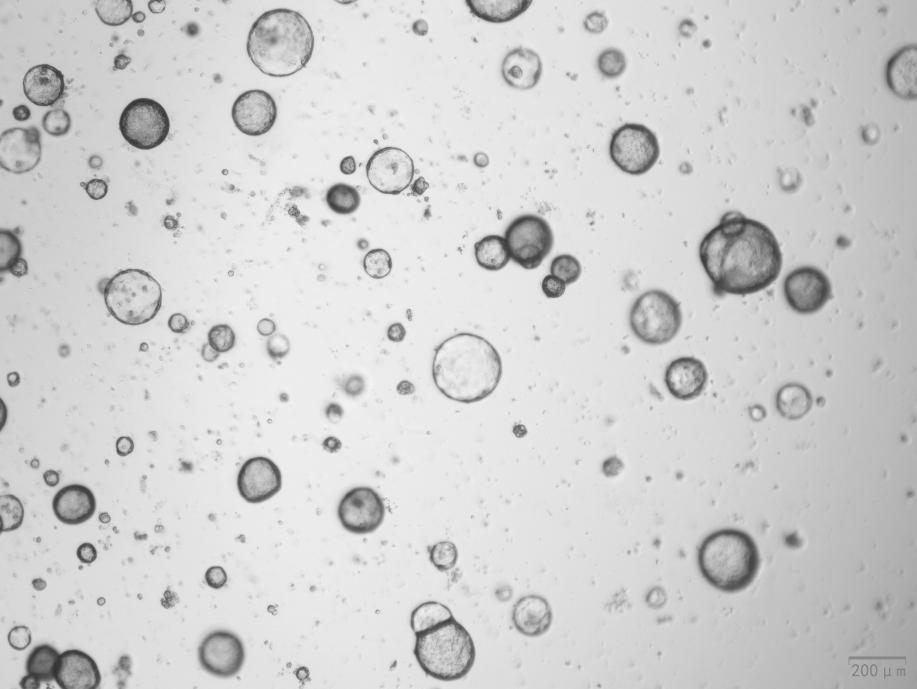
小鼠胃類器官與 EGF (Cat#C029)、Wnt3a (Cat#C22R)、Noggin (Cat#C028)、R-spondin 1 (Cat#CX83) 和 FGF-10 (Cat#CR11) 一起培養。類器官表現出良好的形態。
面臨的挑戰
目前,科學家們已經透過各種不同的培養體系成功建立了豐富的類器官類型,包括胃腸類器官、腎臟、肝、肺、心臟以及複雜的腦類器官等,由於培養週期短,可遺傳代、凍存並維持穩定遺傳,並且可以模擬人體器官的真實生理反應,已廣泛探索各種疾病發生與安全機制、藥物篩選、藥物性評估以及國內移植等多個領域。
但目前類器官仍存在明顯的局限性,例如,如何在類器官中引入血管系統,如何使類器官與複雜的神經網絡以及免疫系統建立連接,以及如涉及臨床治療的效果,如何建立標準化在類器官培養系統等方面,這些問題的前期待解決將是類器官研究領域探索的重點。
參考文獻
[1] Kim J,Koo BK,Knoblich JA。人類類器官:人類生物學和醫學的模型系統。Nat Rev Mol 細胞生物學。2020 年 10 月;21(10):571-584。
[2] Sato T、Vries RG、Snippert HJ、van de Wetering M、Barker N、Stange DE、van Es JH、Abo A、Kujala P、Peters PJ、Clevers H。單一 Lgr5 幹細胞在體外構建隱窩絨毛結構沒有間質生態位。自然。2009 年 5 月 14 日;459(7244):262-5。
